Nuevos artículos
Activación de la inmunidad innata: una parte importante del mecanismo identificado
Último revisado: 02.07.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
Investigadores de la LMU han descifrado la compleja interacción de varias enzimas alrededor del receptor inmune innato Toll-like receptor 7 (TLR7), que juega un papel importante en la protección de nuestro cuerpo contra los virus.
El receptor tipo Toll 7 (TLR7), ubicado en las células dendríticas de nuestro sistema inmunitario, desempeña un papel fundamental en nuestra defensa natural contra los virus. El TLR7 reconoce el ARN monocatenario viral y otros ARN extraños, y activa la liberación de mediadores inflamatorios. Las disfunciones de este receptor también desempeñan un papel clave en las enfermedades autoinmunes, lo que refuerza aún más la importancia de comprender y, idealmente, modular el mecanismo de activación del TLR7.
Los investigadores, dirigidos por el profesor Veit Hornung y Marlene Berouti, del Centro de Genética de Múnich y del Departamento de Bioquímica de la LMU, pudieron profundizar en el complejo mecanismo de activación. Estudios previos ya demostraban que las moléculas complejas de ARN deben cortarse para que el receptor pueda reconocerlas.
Utilizando diversas tecnologías, desde biología celular hasta criomicroscopía electrónica, investigadores de la LMU han descubierto cómo se procesa el ARN monocatenario foráneo para detectar TLR7. Su trabajo se publicó en la revista Immunity.
Numerosas enzimas intervienen en el reconocimiento del ARN extraño.
A lo largo de la evolución, el sistema inmunitario se ha especializado en reconocer patógenos por su material genético. Por ejemplo, el receptor inmunitario innato TLR7 es estimulado por el ARN viral. Podemos pensar en el ARN viral como largas cadenas de moléculas demasiado grandes para ser reconocidas como ligandos del TLR7. Aquí es donde entran en juego las nucleasas: herramientas de corte molecular que cortan la cadena de ARN en pequeños fragmentos.
Las endonucleasas cortan las moléculas de ARN por la mitad, como tijeras, mientras que las exonucleasas escinden la cadena de extremo a extremo. Este proceso genera diferentes fragmentos de ARN que pueden unirse a dos cavidades distintas en el receptor TLR7. Solo cuando ambas cavidades de unión del receptor están ocupadas por estos fragmentos de ARN, se desencadena una cascada de señalización que activa la célula y desencadena un estado de alarma.
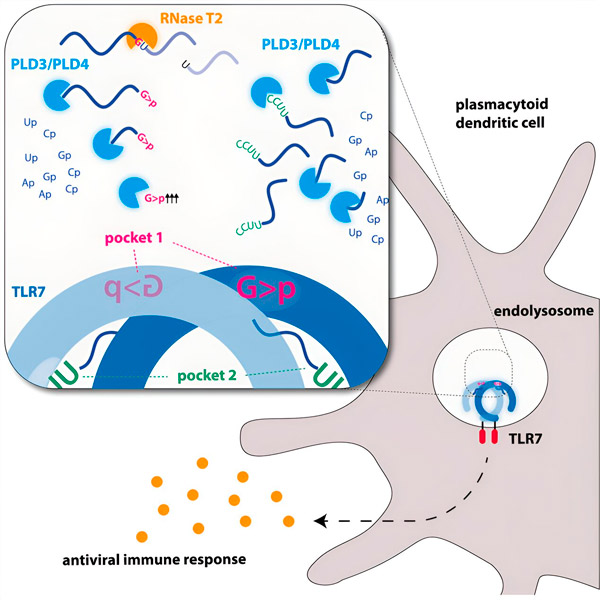
Imagen gráfica. Fuente: Immunity (2024). DOI: 10.1016/j.immuni.2024.04.010
Los investigadores descubrieron que el reconocimiento del ARN por TLR7 requiere la actividad de la endonucleasa ARNasa T2, que actúa en conjunto con las exonucleasas PLD3 y PLD4 (fosfolipasas D3 y D4). «Si bien se sabía que estas enzimas podían degradar el ARN», afirma Hornung, «ahora hemos demostrado que interactúan con TLR7 y, por lo tanto, lo activan».
Equilibrar el sistema inmunológico
Los investigadores también descubrieron que las exonucleasas de PLD desempeñan una doble función en las células inmunitarias. En el caso de TLR7, tienen un efecto proinflamatorio, mientras que en el caso de otro receptor TLR, TLR9, tienen un efecto antiinflamatorio. «Esta doble función de las exonucleasas de PLD indica un equilibrio finamente coordinado para controlar las respuestas inmunitarias adecuadas», explica Berouti.
La estimulación e inhibición simultáneas de la inflamación por estas enzimas puede servir como un importante mecanismo de protección para prevenir disfunciones en el sistema. El papel que otras enzimas podrían desempeñar en esta vía de señalización y si las moléculas implicadas son idóneas como diana terapéutica serán objeto de futuras investigaciones.
