Nuevos artículos
Los científicos rastrean los primeros cambios físicos en las células que causan cáncer
Último revisado: 02.07.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
Cuando se diagnostica un cáncer, ya existen muchos eventos a nivel celular y molecular que han estado ocurriendo desapercibidos. Si bien el cáncer se clasifica en etapas tempranas y tardías para fines clínicos, incluso un tumor en etapa temprana es el resultado de muchos cambios previos en el cuerpo que eran indetectables.
Ahora, científicos de la Facultad de Medicina de la Universidad de Yale (YSM) y sus colegas han obtenido un conocimiento detallado de algunos de estos cambios tempranos, utilizando una potente microscopía de alta resolución para rastrear los primeros cambios físicos causantes de cáncer en las células de la piel de ratones.
Al estudiar ratones portadores de una mutación que promueve el cáncer en sus folículos pilosos, los científicos descubrieron que los primeros signos de formación de cáncer se producen en un momento y lugar específicos del crecimiento de los folículos pilosos de los ratones. Además, descubrieron que estos cambios precancerosos pueden bloquearse con fármacos conocidos como inhibidores de MEK.
El equipo estuvo dirigido por Tianchi Xin, PhD, investigador asociado del Departamento de Genética de YSM, e incluyó a Valentina Greco, PhD, profesora de genética en YSM y miembro del Centro de Cáncer de Yale y del Centro de Células Madre de Yale, y Sergi Regot, PhD, profesor asociado de biología molecular y genética en la Facultad de Medicina de Johns Hopkins.
Los resultados de su investigación fueron publicados en la revista Nature Cell Biology.
Los científicos estudiaron ratones que desarrollan carcinoma escamocelular cutáneo, el segundo tipo de cáncer de piel más común en humanos. Estos ratones fueron modificados genéticamente con una mutación cancerígena en el gen KRAS, uno de los oncogenes con mayor mutación en cánceres humanos. También se han encontrado mutaciones en KRAS en cánceres de pulmón, páncreas y colorrectal.
Los cambios tempranos que estudiaron los científicos incluyeron el crecimiento de una pequeña protuberancia anormal en el folículo piloso, clasificada como una anomalía precancerosa. «Comprender estos eventos tempranos podría ayudarnos a desarrollar estrategias para prevenir la formación del cáncer», afirmó Xin, primera autora del estudio.
Aunque su estudio se centra en el cáncer de piel, los investigadores creen que los principios que descubrieron podrían aplicarse a muchos otros tipos de cáncer causados por mutaciones de KRAS porque los genes y proteínas clave involucrados en estos procesos son los mismos en todos los tumores.
Más que solo proliferación celular. Tanto en humanos como en ratones, los folículos pilosos crecen constantemente, eliminando el cabello viejo y formando uno nuevo. Las células madre, capaces de transformarse en diferentes tipos celulares, desempeñan un papel fundamental en este proceso de renovación. Estudios previos han demostrado que las mutaciones de KRAS provocan una mayor proliferación de células madre en los folículos pilosos, y se creía que este gran aumento de células madre era responsable del trastorno tisular precanceroso.
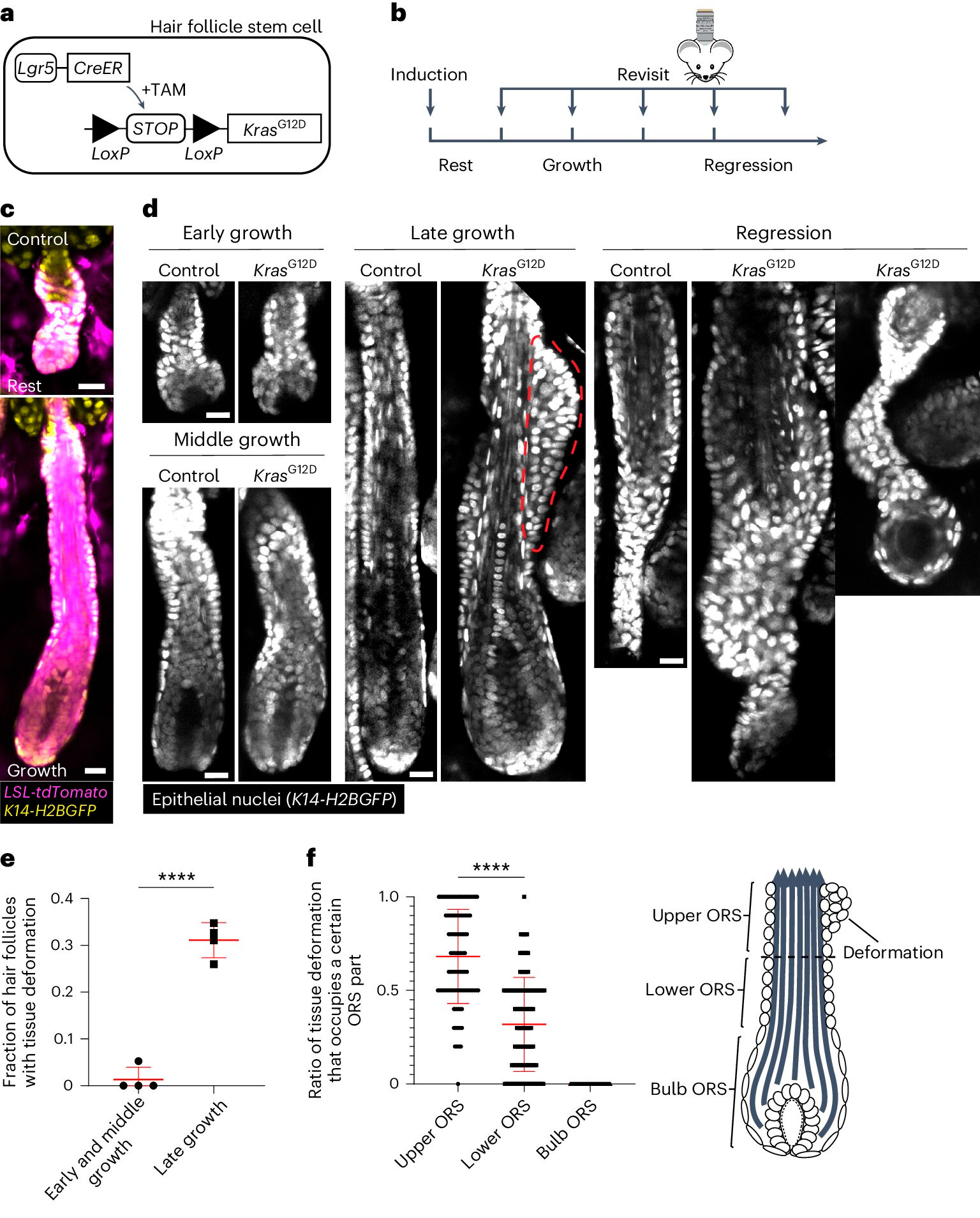
KrasG12D induce deformaciones tisulares específicas espaciotemporales durante la regeneración del folículo piloso.
A. Esquema del enfoque genético para inducir KrasG12D en células madre del folículo piloso utilizando el sistema Cre–LoxP (TAM) inducible por tamoxifeno.
B. Esquema que muestra el momento de la inducción de KrasG12D y la reimagen en relación con las etapas del ciclo piloso.
C. Imágenes representativas de folículos pilosos inactivos y en crecimiento de tipo silvestre que contienen el reportero tdTomato (Magenta) inducible por Cre después de la inducción.
D. Imágenes representativas de folículos pilosos de control y KrasG12D en diferentes etapas del ciclo piloso. La deformación tisular como tubérculos en la vaina radicular externa (SRO) se indica con la línea punteada roja.
E. Proporción de folículos pilosos KrasG12D con deformación tisular en diferentes etapas del crecimiento del folículo piloso.
F. Proporción de deformaciones tisulares que ocupan las partes superior, inferior y bulbosa de la SRO para folículos pilosos KrasG12D individuales.
Fuente: Nature Cell Biology (2024). DOI: 10.1038/s41556-024-01413-y
Para probar esta idea, el equipo utilizó una forma especialmente diseñada de KRAS mutado que podían activar en momentos específicos en las células cutáneas de los folículos pilosos de los animales. Xin y sus colegas emplearon una técnica de microscopía conocida como imagen intravital, que permite obtener imágenes celulares de alta resolución in vivo y marcar y rastrear células madre individuales en los animales.
Cuando se activó la mutación KRAS, todas las células madre comenzaron a proliferar más rápido, pero el bulto precanceroso se formó solo en un lugar específico en el folículo piloso y en una etapa de crecimiento, lo que significa que el aumento general en el número de células probablemente no fue toda la historia.
La activación de la mutación KRAS en los folículos pilosos provocó que las células madre proliferaran más rápidamente, cambiaran sus patrones de migración y se dividieran en diferentes direcciones en comparación con las células sin la mutación promotora del cáncer.
La mutación afecta a una proteína conocida como ERK. Xin logró monitorear la actividad de ERK en tiempo real en células madre individuales de animales vivos y detectó un cambio específico en la actividad de esta proteína causado por la mutación KRAS. Los investigadores también lograron detener la formación del bulto precanceroso mediante un inhibidor de MEK, que bloquea la actividad de ERK.
El medicamento detuvo los efectos de la mutación sobre la migración y la orientación celular, pero no sobre la proliferación general de células madre, lo que significa que la formación de la condición precancerosa es impulsada por estos dos primeros cambios, en lugar de una mayor proliferación celular.
Cambios precancerosos en contexto. El seguimiento de los efectos de una mutación oncogénica en tiempo real en un organismo vivo es la única manera en que los investigadores han podido descubrir estos principios. Esto es importante porque los cánceres no se forman en el vacío; dependen en gran medida de su microambiente para crecer y mantenerse. Los científicos también necesitaban rastrear no solo el comportamiento de las células individuales, sino también las moléculas dentro de ellas.
"El enfoque que hemos adoptado para comprender estos eventos oncogénicos se basa en la conexión entre diferentes escalas", afirmó Greco. "La estructura y los enfoques que han utilizado el Dr. Xin y el Dr. Regot nos han permitido llegar a los elementos moleculares, conectándolos a la escala celular y tisular, lo que nos proporciona una comprensión de estos eventos tan difícil de lograr fuera de un organismo vivo".
Los investigadores ahora quieren seguir el proceso durante un período más largo para ver qué sucede tras la formación del bulto inicial. También quieren estudiar otros eventos oncogénicos, como la inflamación, para comprobar si los principios descubiertos se aplican en otros contextos.
