Nuevos artículos
Identifican una proteína clave para prevenir la pérdida de masa ósea en la osteoporosis
Último revisado: 02.07.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
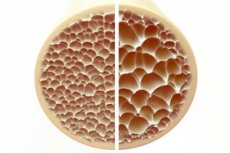
La osteoporosis, una enfermedad caracterizada por huesos porosos y frágiles, representa una amenaza significativa para la salud ósea. Los huesos, como principal soporte estructural del cuerpo humano, proporcionan un soporte vital. Cuando la masa ósea disminuye, no solo se deteriora este soporte, sino también la función general, lo que conlleva una disminución de la calidad de vida.
A medida que aumenta la incidencia de la osteoporosis en la población mayor, aumenta la carga sobre los recursos sanitarios destinados a cuidados a largo plazo. Por lo tanto, es necesario comprender los mecanismos que contribuyen al desarrollo de la osteoporosis y desarrollar tratamientos específicos eficaces para minimizar su impacto a largo plazo.
Los osteoblastos y los osteoclastos son dos tipos de células que desempeñan un papel fundamental en el mantenimiento y la remodelación del tejido óseo. Mientras que los osteoblastos son células formadoras de hueso, responsables de la síntesis y la deposición de tejido óseo nuevo, los osteoclastos son células degradantes óseas que participan en la descomposición y eliminación del tejido óseo viejo o dañado.
Un aumento en la proporción de osteoclastos provoca pérdida ósea en afecciones como la osteoporosis, la artritis reumatoide (inflamación de las articulaciones) y las metástasis óseas (cáncer que se ha propagado a los huesos). Los osteoclastos surgen de la diferenciación de macrófagos o monocitos, que son tipos de células inmunitarias.
Por lo tanto, la inhibición de la diferenciación osteoclástica podría servir como estrategia terapéutica para prevenir la pérdida ósea. Sin embargo, los mecanismos moleculares precisos que regulan el complejo proceso de remodelación ósea siguen sin estar claros.
En un nuevo estudio, el profesor Tadayoshi Hayata, el Sr. Takuto Konno y la Sra. Hitomi Murachi, de la Universidad de Ciencias de Tokio, junto con sus colegas, profundizaron en la regulación molecular de la diferenciación de los osteoclastos. La estimulación con el ligando del activador del receptor del factor nuclear kappa B (RANKL) induce la diferenciación de macrófagos en osteoclastos.
Además, las vías de señalización de la proteína morfogenética ósea (BMP) y del factor de crecimiento transformante (TGF-β) se han implicado en la regulación de la diferenciación osteoclástica mediada por RANKL. En el presente estudio, los investigadores se propusieron investigar la función de Ctdnep1, una fosfatasa (enzima que elimina grupos fosfato) que, según se ha descrito, suprime las vías de señalización de BMP y TGF-β.
El estudio se publica en la revista Biochemical and Biophysical Research Communications.
El profesor Hayata afirma: «RANKL actúa como un «acelerador» para la diferenciación de los osteoclastos. Conducir un coche requiere no solo un acelerador, sino también frenos. En este estudio, descubrimos que Ctdnep1 actúa como un «freno» en la diferenciación de los osteoclastos».
Los investigadores examinaron primero la expresión de Ctdnep1 en macrófagos de ratón tratados con RANKL y en células de control sin tratar. Observaron que la expresión de Ctdnep1 no se modificaba en respuesta a la estimulación con RANKL. Sin embargo, se localizaba en el citoplasma en forma granular en los macrófagos y se diferenciaba en osteoclastos, a diferencia de su localización perinuclear normal en otros tipos celulares, lo que indica su función citoplasmática en la diferenciación osteoclástica.
Además, la eliminación de Ctdnep1 (regulación negativa de la expresión genética) resultó en un aumento en el número de osteoclastos positivos para la fosfatasa ácida resistente al tartrato (TRAP), donde TRAP es un marcador de osteoclastos diferenciados.
La inactivación de Ctdnep1 resultó en un aumento de la expresión de marcadores clave de diferenciación, incluyendo "Nfatc1", un factor de transcripción maestro inducido por RANKL para la diferenciación osteoclástica. Estos resultados respaldan la función de freno de Ctdnep1, regulando negativamente la diferenciación osteoclástica. Además, la inactivación de Ctdnep1 también resultó en un aumento de la absorción de fosfato de calcio, lo que sugiere un papel supresor de Ctdnep1 en la resorción ósea.
Finalmente, aunque la inactivación de Ctdnep1 no alteró la señalización de BMP y TGF-β, las células deficientes en Ctdnep1 mostraron niveles elevados de proteínas fosforiladas (activadas), productos de la vía de señalización RANKL. Estos resultados sugieren que el efecto inhibidor de Ctdnep1 sobre la diferenciación de osteoclastos podría no estar mediado por la señalización de BMP y TGF-β, sino por la regulación negativa de la vía de señalización RANKL y los niveles de proteína Nfatc1.
En general, estos resultados aportan nuevos conocimientos sobre el proceso de diferenciación de los osteoclastos e identifican posibles dianas terapéuticas que podrían utilizarse para desarrollar tratamientos que reduzcan la pérdida ósea causada por la hiperactividad osteoclástica. Además de las enfermedades caracterizadas por la pérdida ósea, Ctdnep1 también se ha identificado como un factor causal del meduloblastoma, un tumor cerebral infantil. Los autores se muestran optimistas respecto a la posibilidad de que su investigación se extienda a otras enfermedades humanas más allá del metabolismo óseo.
El profesor Hayata concluye: «Nuestros resultados sugieren que Ctdnep1 es necesario para prevenir la osteoclastogénesis excesiva. Estos resultados podrían ampliar nuestro conocimiento sobre cómo la red de fosforilación-desfosforilación controla la diferenciación osteoclástica y proporcionar nuevas estrategias terapéuticas para el tratamiento de enfermedades óseas asociadas con la actividad osteoclástica excesiva».
