Nuevos artículos
Hallan una diana para neutralizar las proteínas tóxicas en la enfermedad de Parkinson
Último revisado: 02.07.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
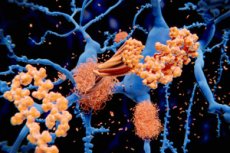
Investigadores de la UAB (Universidad Autónoma de Barcelona) han identificado un sitio en los agregados tempranos de la proteína alfa-sinucleína que puede ser diana para evitar que se convierta en fibrillas amiloides tóxicas que se acumulan en los cerebros de personas con enfermedad de Parkinson.
El descubrimiento fue publicado recientemente en el Journal of the American Chemical Society en un estudio que profundiza la comprensión de las propiedades estructurales de estos agregados iniciales, u oligómeros, y abre la puerta al desarrollo de nuevas estrategias terapéuticas para inactivarlos.
El estudio ha sido realizado por los científicos Salvador Ventura, Jaime Santos, Jordi Pujols e Irantzu Palhares del Instituto de Biotecnología y Biomedicina (IBB) y del Departamento de Bioquímica y Biología Molecular.
La agregación de alfa-sinucleína es un rasgo distintivo de la enfermedad de Parkinson y otras sinucleinopatías. Se trata de un proceso dinámico en el que la proteína se autoensambla para formar oligómeros que finalmente se convierten en fibrillas amiloides tóxicas que se acumulan en el cerebro del paciente.
Los oligómeros de alfa-sinucleína desempeñan un papel fundamental en el desarrollo y la progresión de la enfermedad y, por lo tanto, constituyen prometedoras dianas terapéuticas y diagnósticas, especialmente en las primeras etapas. Sin embargo, su naturaleza transitoria y altamente dinámica limita el estudio de su estructura y dificulta el desarrollo de terapias dirigidas a bloquearlos.
En un estudio previo, los investigadores descubrieron que una pequeña molécula, el péptido bacteriano PSMα3, inhibe la agregación de la alfa-sinucleína al unirse a oligómeros, bloqueando la fibrilación y suprimiendo la neurotoxicidad. En este estudio, determinaron dónde, cómo y cuándo se produce esta unión en los oligómeros, identificando una región clave para el proceso de conversión estructural asociado con la patogénesis de la enfermedad de Parkinson.
"Hemos identificado una secuencia estructural necesaria para convertir oligómeros en fibrillas, lo que abre un nuevo campo para el desarrollo de moléculas dirigidas a oligómeros. Gracias a este campo, podemos diseñar nuevas moléculas que imiten las propiedades de PSMα3 con mucha mayor afinidad y potencia", explica Ventura, director del Grupo de Investigación de Plegamiento de Proteínas y Enfermedades Conformacionales del IBB y coordinador del estudio.
Combinando análisis estructurales, biofísicos y bioquímicos, los investigadores descubrieron que el PSMα3 actúa uniéndose a un extremo de la alfa-sinucleína (el extremo N-terminal), lo que regula el proceso de conversión de oligómeros en fibrillas. Al unirse, el péptido cubre dos pequeñas regiones adyacentes de la proteína, P1 y P2, que han demostrado ser cruciales para esta transición patológica.
"Esta región es un objetivo terapéutico ideal porque solo es reconocida por los péptidos cuando forman parte de oligómeros, lo que nos permite apuntar a los agregados sin afectar la forma monomérica funcional de la alfa-sinucleína, que es esencial para la función cerebral normal", dice Ventura.
El estudio también tiene implicaciones para una mejor comprensión de los mecanismos moleculares de la forma hereditaria de la enfermedad de Parkinson. Esta forma, que suele afectar a personas más jóvenes, suele estar asociada a mutaciones localizadas en la región P2 de la alfa-sinucleína, como la mutación G51D, que causa una de las formas más agresivas de la enfermedad.
Los investigadores demostraron que la mutación G51D en la región crítica identificada causa fluctuaciones conformacionales que ralentizan la conversión de oligómeros en fibrillas. Esta ralentización conduce a la acumulación de oligómeros tóxicos y de larga vida, que son procesados de forma ineficiente por las chaperonas moleculares que intentan desagregarlos.
"Nuestro descubrimiento podría conducir al desarrollo de péptidos específicos que puedan actuar sobre estas formas mutadas de alfa-sinucleína y, por lo tanto, a un enfoque terapéutico personalizado para quienes padecen la forma hereditaria de la enfermedad de Parkinson. Ya estamos trabajando en el desarrollo de estas moléculas", afirma Ventura.
