Nuevos artículos
Clarificación de los mecanismos celulares de la periodontitis con un modelo animal mejorado
Último revisado: 02.07.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
Investigadores de la Universidad Médica y Dental de Tokio (TMDU) han desarrollado una técnica que permite un análisis detallado del desarrollo de la periodontitis a lo largo del tiempo.
La enfermedad periodontal, conocida como periodontitis, es la principal causa de pérdida de dientes y afecta a casi uno de cada cinco adultos en todo el mundo. En la mayoría de los casos, esta afección se debe a una respuesta inflamatoria a una infección bacteriana de los tejidos que rodean los dientes.
A medida que la enfermedad empeora, las encías comienzan a retraerse, dejando expuestas las raíces de los dientes y el hueso. Cabe destacar que la incidencia de la periodontitis aumenta con la edad, y dado que la población mundial vive más, es importante comprender bien sus causas subyacentes y su progresión.
En un estudio publicado en la revista Nature Communications, investigadores de TMDU encontraron una forma de lograr este objetivo mejorando un modelo animal ampliamente utilizado para estudiar la periodontitis.
El estudio directo de la periodontitis en humanos es difícil. Por ello, los científicos suelen recurrir a modelos animales para estudios preclínicos. Por ejemplo, el "modelo murino de periodontitis inducida por ligadura" ha permitido a los investigadores estudiar los mecanismos celulares subyacentes a la enfermedad desde su introducción en 2012.
En pocas palabras, este modelo induce artificialmente la enfermedad periodontal mediante la colocación de hilos de seda en las muelas de ratones, lo que provoca la acumulación de placa. Si bien este método es práctico y eficaz, no abarca la totalidad de la periodontitis.
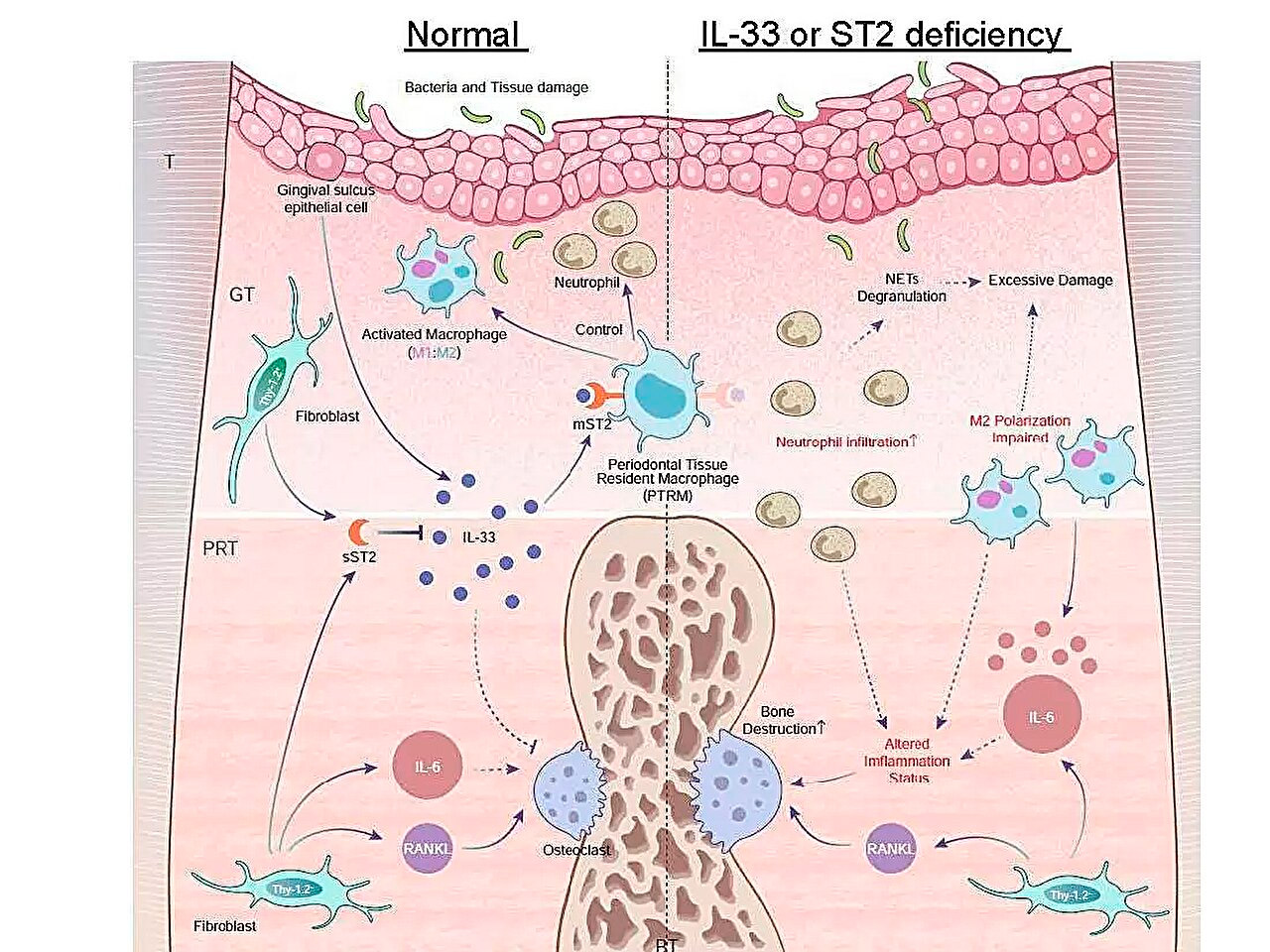
Ilustración esquemática de los perfiles de expresión génica inflamatoria durante la periodontitis y la función del eje IL-33/ST2 en el control de la inflamación aguda. Fuente: Universidad Médica y Dental de Tokio.
«Aunque el tejido periodontal consta de encía, ligamento periodontal, hueso alveolar y cemento, el análisis suele realizarse únicamente en muestras de encía debido a limitaciones técnicas y cuantitativas», señala el autor principal del estudio, Anhao Liu. «Esta estrategia de muestreo limita las conclusiones que se pueden extraer de estos estudios, por lo que se necesitan métodos que permitan el análisis simultáneo de todos los componentes del tejido».
Para abordar esta limitación, el equipo de investigación desarrolló un modelo modificado de periodontitis inducida por ligadura. En lugar de la clásica ligadura simple, utilizaron una ligadura triple en el molar superior izquierdo de ratones macho. Esta estrategia amplió el área de pérdida ósea sin destruir significativamente el hueso alrededor del segundo molar, aumentando así la cantidad de diferentes tipos de tejido periodontal.
"Aislamos tres tipos principales de tejido y evaluamos la producción de ARN entre ambos modelos. Los resultados mostraron que el modelo de triple ligadura aumentó eficazmente la producción, logrando cuatro veces la cantidad de tejido perirradicular normal y facilitando el análisis de alta resolución de diferentes tipos de tejido", explica el autor principal, el Dr. Mikihito Hayashi.
Después de confirmar la eficacia de su modelo modificado, los investigadores se propusieron estudiar los efectos de la periodontitis en la expresión genética en diferentes tipos de tejidos a lo largo del tiempo, centrándose en los genes asociados con la inflamación y la diferenciación de los osteoclastos.
Uno de sus hallazgos clave fue que la expresión del gen Il1rl1 fue significativamente mayor en el tejido perirradicular cinco días después de la ligadura. Este gen codifica la proteína ST2 en las isoformas receptora y señuelo, que se une a una citocina llamada IL-33, implicada en procesos inflamatorios e inmunorreguladores.
Para comprender mejor la función de este gen, el equipo indujo periodontitis en ratones modificados genéticamente que carecían de los genes Il1rl1 o Il33. Estos ratones mostraron una destrucción ósea inflamatoria acelerada, lo que pone de relieve el papel protector de la vía IL-33/ST2. Un análisis más detallado de las células que contenían la proteína ST2 en su forma receptora, mST2, reveló que la mayoría provenían de macrófagos.
Los macrófagos se clasifican generalmente en dos tipos principales: proinflamatorios y antiinflamatorios, según su activación. Descubrimos que las células que expresan mST2 eran únicas, ya que expresaban simultáneamente algunos marcadores de ambos tipos de macrófagos —comentó el Dr. Takanori Iwata, autor principal del estudio—. Estas células ya estaban presentes en el tejido perirradicular antes del inicio de la inflamación, por lo que las denominamos "macrófagos residentes en el tejido periodontal".
En conjunto, los resultados de este estudio demuestran el poder de un modelo animal modificado para estudiar la periodontitis a una escala más detallada, hasta el nivel biomolecular.
"Proponemos la posibilidad de una nueva vía molecular IL-33/ST2 que regule la inflamación y la destrucción ósea en la enfermedad periodontal, junto con macrófagos específicos del tejido perirradicular que están profundamente involucrados en la enfermedad periodontal. Esperamos que esto conduzca al desarrollo de nuevas estrategias de tratamiento y métodos de prevención", concluye el autor principal, el Dr. Tomoki Nakashima.
