Nuevos artículos
El fármaco LM11A-31 frena la progresión de la enfermedad de Alzheimer en un ensayo
Último revisado: 02.07.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.

En un estudio reciente publicado en la revista Nature Medicine, los científicos llevaron a cabo un estudio de fase 2a aleatorizado, doble ciego y controlado con placebo para examinar la seguridad y eficacia de LM11A-31 en el tratamiento de la enfermedad de Alzheimer (EA) a través de la modulación del receptor de neurotrofina p75 (p75NTR).
La EA de inicio tardío es la forma más común de demencia, caracterizada por fallo sináptico, degeneración y pérdida de células nerviosas. Si bien los dos fármacos principales para el tratamiento de la EA se dirigen a la acumulación de proteínas amiloide-β o tau anormales, solo abordan parte de la fisiopatología. Otro enfoque consiste en actuar sobre receptores y redes de señalización que influyen en vías biológicas fundamentales. Estudios preclínicos demuestran que la modulación de p75NTR con una nueva molécula química pequeña, LM11A-31, reduce la pérdida sináptica causada por amiloide y tau anormal.
Descripción del estudio
En este ensayo clínico aleatorizado, los investigadores examinaron si LM11A-31 podría retardar la progresión de la enfermedad de Alzheimer modulando p75NTR en humanos.
Los participantes del estudio recibieron cápsulas orales de LM11A-31 en dosis de 200 mg y 400 mg o placebo en una proporción 1:1:1 a 242 pacientes con asma leve a moderada durante 26 semanas. Los participantes presentaban enfermedad de Alzheimer confirmada biológicamente (nivel de proteína β amiloide 42 (Aβ42) en líquido cefalorraquídeo inferior a 550 ng/l o proporción Aβ42:β40 inferior a 0,89) diagnosticada según los criterios de McKhann, con puntuaciones en el Mini-Psychiatric Examination (MMSE) de 18 a 26, puntuaciones en la Escala de Depresión Geriátrica (GDS) inferiores a 5,0, puntuaciones en la Escala Isquémica de Hachinski modificada (HIS) ≤ 4,0, educación formal ≥ 8 años y deterioro cognitivo previo ≥ 6 meses.
Los participantes elegibles habían tomado inhibidores de la acetilcolinesterasa (ACEI) o antagonistas parciales del receptor NMDA durante ≥ 3 meses antes del ingreso al estudio. No consumían drogas ilegales como antipsicóticos, benzodiazepinas, antiepilépticos, sedantes, antihipertensivos de acción central, nootrópicos (excepto ginkgo biloba) ni analgésicos con opioides.
El resultado principal del estudio fue la seguridad y la tolerabilidad, evaluadas mediante la Escala de Clasificación de Gravedad de Pensamientos y Conductas Suicidas de Columbia (C-SSRS), las constantes vitales, la presión arterial y los parámetros hematológicos. Se utilizaron imágenes por resonancia magnética estructural (IRMc), tomografía por emisión de positrones con fluorodesoxiglucosa (FDG-PET) y biomarcadores del líquido cefalorraquídeo (LCR) para evaluar los resultados cognitivos secundarios. Las mediciones de la EA incluyeron la actividad de la tau fosforilada en Thr181, la proteína tau total, Aβ40, Aβ42 y la actividad de la acetilcolina (AChE). El equipo utilizó una prueba neuropsicológica personalizada para evaluar los resultados cognitivos secundarios al inicio del estudio y en las semanas 12 y 26.
Resultados de la investigación
El estudio determinó que el LM11A-31 es seguro y bien tolerado, sin problemas de seguridad significativos. Los eventos adversos más comunes incluyeron cefalea, diarrea, eosinofilia y nasofaringitis, siendo los problemas gastrointestinales y la eosinofilia las principales razones de interrupción. Hubo más interrupciones en el grupo de 400 mg en comparación con los grupos de 200 mg y placebo. La resonancia magnética no reveló problemas de seguridad, incluyendo anomalías relacionadas con amiloide. No se observaron diferencias significativas en las puntuaciones cognitivas ni en las anomalías amiloideas entre los dos grupos de tratamiento.
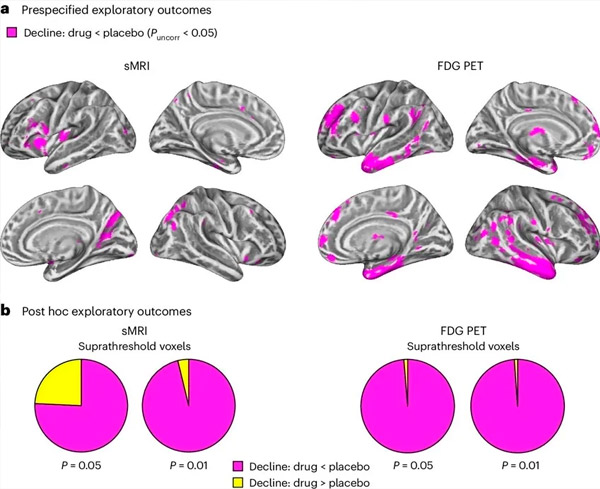
A. El análisis de covarianza de modelos mixtos bidireccional examinó las interacciones entre el tratamiento (fármaco o placebo) y el tiempo (antes o después del tratamiento). Un contraste t de una cola, que examinó la hipótesis de interacción (el fármaco ralentiza la progresión en comparación con el placebo), mostró que el tratamiento con LM11A-31 ralentizó la degeneración longitudinal (paneles izquierdos) y el hipometabolismo glucémico (paneles derechos) en el grupo del fármaco (cMRI, n = 127; PET, n = 121) en comparación con el grupo placebo (cMRI, n = 66; PET, n = 62). Los vóxeles que muestran esta interacción se muestran con un umbral sin corregir de P < 0,05 (magenta) en una superficie cortical específica de la población. Los hemisferios izquierdo y derecho se muestran en las filas superior e inferior, respectivamente. Las regiones cerebrales que muestran interacciones incompatibles con la hipótesis se muestran en la Figura 7 de los Datos Suplementarios.
B. Número total de vóxeles en regiones cerebrales vulnerables predefinidas para la enfermedad de Alzheimer (área total de los gráficos circulares) que muestran una interacción acorde con la hipótesis (magenta) o incompatible con la hipótesis (amarillo) en cada modalidad de imagen (cMRI, panel izquierdo; FDG PET, panel derecho) con umbrales cada vez más liberales de P < 0,01 y P < 0,05 sin corregir. Las simulaciones de Monte Carlo mostraron que las proporciones de vóxeles con efectos acordes con la hipótesis frente a incompatibles con la hipótesis fueron significativamente mayores que las observadas con base en datos generados aleatoriamente tanto para cMRI como para PET (P < 0,001 para cada modalidad; prueba bilateral).
LM11A-31 redujo eficazmente el aumento de Aβ42 y Aβ40 en el LCR en comparación con el grupo placebo. El fármaco también mostró una reducción en la mediana del cambio porcentual anual del biomarcador proteico presináptico SNAP25 y una disminución del biomarcador postsináptico NG, lo que indica una ralentización de la pérdida de conexiones presinápticas y postsinápticas. LM11A-31 también redujo el aumento de YKL40, lo que condujo a una disminución en las puntuaciones del MMSE y a un aumento en las puntuaciones de ADAS-Cog-13. El fármaco también redujo la pérdida de materia gris en el lóbulo frontal y la corteza parietal posterior, así como una disminución del metabolismo de la glucosa en áreas como la corteza entorrinal, la corteza temporal, el hipocampo, la corteza insular y la corteza prefrontal.
Conclusión
El estudio concluyó que la modulación de p75NTR por LM11A-31 es adecuada para ensayos clínicos de mayor envergadura. LM11A-31 cumplió con el criterio principal de valoración de seguridad y fue bien tolerado en pacientes con EA de leve a grave. Los resultados indican la necesidad de realizar estudios adicionales con tratamientos más prolongados para evaluar el potencial de las moléculas pequeñas para regular p75NTR como terapia modificadora de la enfermedad en la EA. El estudio demostró que LM11A-31 afectó significativamente a varios biomarcadores, como Aβ40, Aβ42, SNAP25, NG e YKL40, lo que indica una ralentización de la progresión patológica. Estudios futuros podrían evaluar indicadores adicionales de la salud glial.
