Nuevos artículos
El sueño limpia el cerebro de toxinas y metabolitos
Último revisado: 02.07.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.

Un estudio reciente publicado en la revista Nature Neuroscience descubrió que la limpieza del cerebro se reduce durante la anestesia y el sueño.
El sueño es un estado de inactividad vulnerable. Dados los riesgos de esta vulnerabilidad, se ha sugerido que dormir puede aportar ciertos beneficios. Se ha sugerido que el sueño elimina toxinas y metabolitos del cerebro a través del sistema glinfático. Esta sugerencia tiene implicaciones importantes; por ejemplo, la reducción de la eliminación de toxinas debido a la falta crónica de sueño puede agravar la enfermedad de Alzheimer.
Los mecanismos y las vías anatómicas mediante las cuales se eliminan toxinas y metabolitos del cerebro siguen siendo inciertos. Según la hipótesis glinfática, el flujo basal, impulsado por los gradientes de presión hidrostática de las pulsaciones arteriales, elimina activamente las sales del cerebro durante el sueño de ondas lentas. Además, las dosis sedantes de anestésicos mejoran la depuración. Se desconoce si el sueño mejora la depuración mediante el aumento del flujo basal.
En este estudio, los investigadores midieron el movimiento de fluidos y la depuración cerebral en ratones. Primero, determinaron el coeficiente de difusión del isotiocianato de fluoresceína (FITC)-dextrano, un colorante fluorescente. Se inyectó FITC-dextrano en el núcleo caudado y se midió la fluorescencia en la corteza frontal.
Los experimentos iniciales consistieron en esperar a alcanzar el estado estacionario, blanquear el tinte en un pequeño volumen de tejido y determinar el coeficiente de difusión midiendo la velocidad de movimiento del tinte sin blanquear en la zona blanqueada. La técnica se validó midiendo la difusión de FITC-dextrano en geles de agarosa que simulaban el cerebro, modificados para aproximarse a la absorción óptica y la dispersión de la luz del cerebro.
Los resultados mostraron que el coeficiente de difusión del FITC-dextrano no difirió entre los estados de anestesia y sueño. Posteriormente, el equipo midió el aclaramiento cerebral en diferentes estados de vigilia. Utilizaron un pequeño volumen del colorante fluorescente AF488 en ratones a los que se les inyectó solución salina o anestésico. Este colorante se movió libremente en el parénquima y pudo ayudar a cuantificar con precisión el aclaramiento cerebral. También se realizaron comparaciones entre los estados de vigilia y sueño.
En concentraciones máximas, la depuración fue del 70-80 % en ratones tratados con solución salina, lo que indica que los mecanismos normales de depuración no se vieron afectados. Sin embargo, la depuración se redujo significativamente con el uso de anestésicos (pentobarbital, dexmedetomidina y ketamina-xilazina). Además, la depuración también se redujo en ratones dormidos en comparación con ratones despiertos. No obstante, el coeficiente de difusión no mostró diferencias significativas entre los estados anestesiado y dormido.
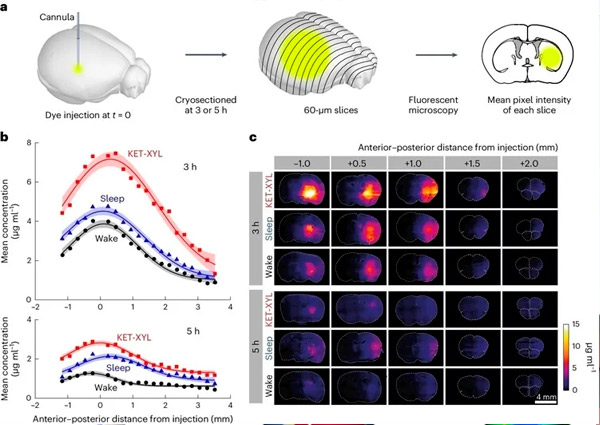
A. Tres o cinco horas después de la inyección de AF488 en la CPU, los cerebros se congelaron y se cortaron en criosecciones de 60 μm de grosor. La intensidad media de fluorescencia de cada sección se midió mediante microscopía de fluorescencia; posteriormente, se promediaron las intensidades medias de grupos de cuatro secciones.
B. La intensidad media de fluorescencia se convirtió en concentración utilizando los datos de calibración presentados en la Figura Suplementaria 1 y se graficó contra la distancia anteroposterior desde el punto de inyección para los estados de vigilia (negro), sueño (azul) y anestesia KET-XYL (rojo). La parte superior muestra los datos a las 3 horas. La parte inferior muestra los datos a las 5 horas. Las líneas representan ajustes gaussianos a los datos, y las barras de error muestran intervalos de confianza del 95%. Tanto a las 3 como a las 5 h, las concentraciones de KET-XYL durante la anestesia (P < 10⁻⁶ a las 3 h; P < 10⁻⁶ a las 5 h) y el sueño (P = 0,0016 a las 3 h; P < 10⁻⁴ a las 5 h) fueron significativamente mayores que las observadas durante la vigilia (ANOVA de dos vías con corrección de comparación múltiple de Bonferroni-Holm).
C. Imágenes representativas de secciones cerebrales a diferentes distancias (anteroposterior) del sitio de inyección de AF488 después de 3 horas (tres filas superiores) y después de 5 horas (tres filas inferiores). Cada fila representa datos de tres estados de vigilia (vigilia, sueño y anestesia KET-XYL).
El estudio reveló una reducción del aclaramiento cerebral durante la anestesia y el sueño, lo que contradice informes previos. El aclaramiento puede variar según la zona anatómica, pero el grado de variación puede ser pequeño. Sin embargo, la inhibición del aclaramiento por ketamina-xilazina fue significativa e independiente de la zona.
Nicholas P. Franks, uno de los autores del estudio, afirmó: «El campo de investigación se ha centrado tanto en la idea de la limpieza como una de las razones clave por las que dormimos que nos sorprendieron mucho los resultados opuestos».
Es particularmente importante destacar que los resultados se refieren a un pequeño volumen de tinte que se mueve libremente en el espacio extracelular. Las moléculas más grandes pueden presentar un comportamiento diferente. Además, los mecanismos precisos por los cuales el sueño y la anestesia afectan la depuración cerebral siguen sin estar claros; sin embargo, estos hallazgos desafían la idea de que la función principal del sueño sea depurar el cerebro de toxinas.
