Nuevos artículos
Los derivados de la talidomida provocan la muerte de células cancerosas resistentes
Último revisado: 14.06.2024

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
Un estudio realizado por la Universidad Goethe de Frankfurt señala la posibilidad de que los derivados de la talidomida sean potencialmente adecuados para el tratamiento del cáncer. En la década de 1950, la talidomida se vendía como pastilla para dormir. Posteriormente se hizo famoso por causar graves malformaciones en el feto en las primeras etapas del embarazo.
También se sabe que la molécula marca proteínas en la célula para su destrucción. Como parte de la investigación actual, los científicos crearon derivados de la talidomida. Pudieron demostrar que estas sustancias afectan la destrucción de las proteínas responsables de la supervivencia de las células cancerosas.
Quizás ninguna otra molécula tenga un pasado tan turbulento como la talidomida. Fue el componente principal de un fármaco aprobado en muchos países en la década de 1950 como sedante-hipnótico. Sin embargo, pronto quedó claro que las mujeres embarazadas que tomaban talidomida a menudo daban a luz a niños con deformidades graves.
Sin embargo, en las últimas décadas, la medicina ha vuelto a depositar grandes esperanzas en ello. Las investigaciones han demostrado, entre otras cosas, que inhibe el crecimiento de los vasos sanguíneos y, por tanto, es potencialmente adecuado para aislar los tumores de su medio nutritivo. Luego también demostró ser muy eficaz en el tratamiento del mieloma múltiple, tumores malignos en la médula ósea.
“Ahora sabemos que la talidomida puede considerarse un 'pegamento molecular'”, explica el Dr. Xinglai Cheng del Instituto de Química Farmacéutica de la Universidad Goethe de Frankfurt. "Esto significa que es capaz de agarrar dos proteínas y unirlas".
Esto es especialmente interesante porque una de estas proteínas es una especie de "máquina etiquetadora": coloca una etiqueta inequívoca de "BASURA" a otra proteína.
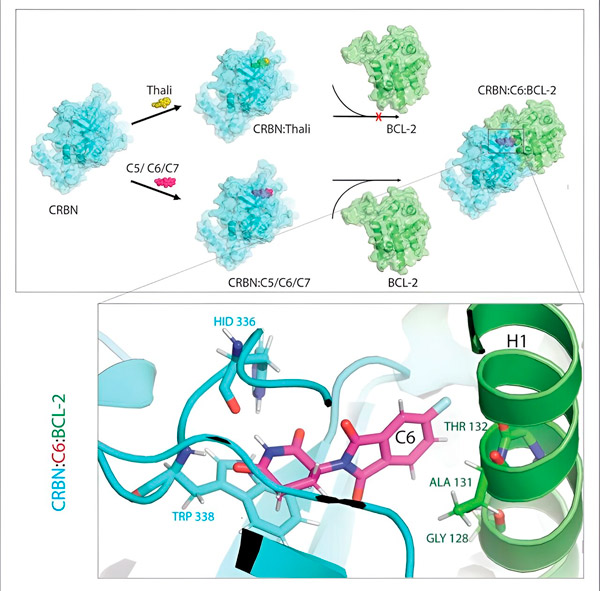
Los derivados de talidomida C5, C6 y C7 modifican CRBN, la "máquina etiquetadora", para que pueda unirse a BCL-2. Por lo tanto, la molécula BCL-2 está marcada para su degradación, una posible nueva estrategia para combatir el cáncer. Autor: Dr. Xinglai Cheng
El sistema de eliminación de desechos de la célula reconoce esta etiqueta: toma la molécula de proteína marcada y la tritura. "Es este mecanismo el que explica los diferentes efectos de la talidomida", afirma Cheng. "Dependiendo de qué proteína se marque, esto puede provocar deformidades durante el desarrollo embrionario o la destrucción de células malignas."
Este mecanismo ofrece una gran promesa médica porque las células cancerosas dependen de ciertas proteínas para sobrevivir. Si pudieran atacarse y destruirse sistemáticamente, la enfermedad podría curarse. El problema es que el pegamento molecular es bastante peculiar.
Uno de sus socios de unión es siempre una máquina de marcado celular o, en lenguaje científico, una ligasa E3 llamada CRBN. Sólo unas pocas de las miles de proteínas del cuerpo pueden ser una segunda compañera, y cuáles dependen del pegamento.
"Así que creamos una serie de derivados de la talidomida", dice Cheng. "Luego investigamos si tenían propiedades adhesivas y, en caso afirmativo, contra qué proteínas eran eficaces". Para ello, los investigadores añadieron sus derivados a todas las proteínas de la línea celular cultivada. Luego observaron cuál de estas proteínas se degradaba en presencia de CRBN.
"En el proceso, identificamos tres derivados que podrían marcar una proteína celular que es muy importante para la degradación, BCL-2", explica Cheng. "BCL-2 impide que las células activen su programa de autodestrucción, por lo que si falta, las células mueren."
Por lo tanto, BCL-2 ha sido durante mucho tiempo el foco de la investigación sobre el cáncer. Incluso ya existe un medicamento para la leucemia llamado venetoclax, que reduce la eficacia de BCL-2 y, por tanto, provoca que las células mutadas se autodestruyan.
"Sin embargo, en muchas células cancerosas, el propio BCL-2 está mutado. Como resultado, venetoclax ya no inhibe la proteína", dice Cheng. "Pudimos demostrar que nuestros derivados también marcan esta forma mutada para su degradación. Además, nuestros socios del Instituto Max Planck de Biofísica simularon en el ordenador la interacción de los derivados de talidomida con BCL-2. Esto demostró que los derivados se unen a sitios completamente diferentes a los de venetoclax, un resultado que más tarde pudimos confirmar experimentalmente."
Además, los investigadores probaron sus sustancias en moscas de la fruta con células cancerosas. La tasa de supervivencia de las moscas tratadas de esta manera fue significativamente mayor. Sin embargo, Cheng advierte que no hay que entusiasmarse demasiado porque estos resultados siguen siendo investigación básica. "Aunque demuestran que las moléculas de talidomida modificadas tienen un gran potencial terapéutico, todavía no podemos decir si se demostrarán en la práctica en algún momento".
Los resultados del estudio se publicaron en la revista Cell Reports Physical Science.
