Médico experto del artículo.
Nuevos artículos
Aborto espontáneo habitual - Causas
Último revisado: 04.07.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
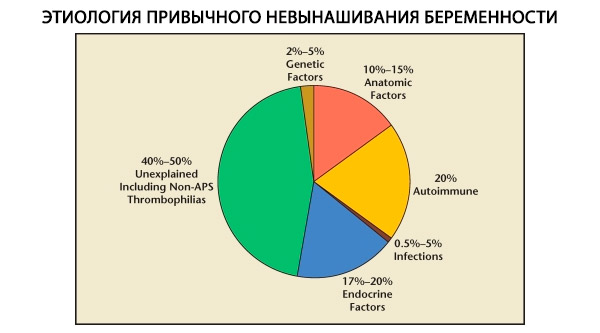
En la estructura de los abortos espontáneos habituales se distinguen factores genéticos, anatómicos, endocrinos, inmunológicos e infecciosos. Al excluir todas las causas mencionadas, queda un grupo de pacientes en quienes el origen del aborto espontáneo habitual es incierto (abortos espontáneos idiopáticos). Según C. Coulam et al. (1996), el 80% de los abortos espontáneos idiopáticos se deben a trastornos inmunitarios no diagnosticados.
No hay evidencia convincente de que la endometriosis cause abortos recurrentes, o de que el tratamiento médico o quirúrgico de la endometriosis reduzca la incidencia de abortos recurrentes.
Según los conceptos actuales, además de las causas genéticas y parcialmente infecciosas que conducen a la formación de un embrión anormal, el efecto perjudicial de otros factores (anatómicos, endocrinos e inmunológicos) consiste en crear un entorno desfavorable para el desarrollo de un óvulo fecundado genéticamente completo, lo que conlleva la disminución de la capacidad de reserva del corion y la interrupción del desarrollo (embriogénesis). Los períodos críticos del primer trimestre del embarazo se reconocen entre la semana 6 y la 8 (muerte del embrión) y la semana 10 y la 12 (expulsión del óvulo fecundado).
 [ 1 ]
[ 1 ]
Causas genéticas del aborto habitual
Los factores genéticos representan entre el 3 y el 6 % de las causas del aborto espontáneo habitual. En la interrupción esporádica del embarazo en el primer trimestre, alrededor del 50 % de los abortos tienen anomalías cromosómicas. La mayoría de ellas (95 %) son cambios en el número de cromosomas: monosomía (pérdida de un cromosoma), trisomía (presencia de un cromosoma adicional), que son resultado de errores en la meiosis, así como poliploidía (un aumento en la composición cromosómica por un conjunto haploide completo), que ocurre cuando un óvulo es fertilizado por dos o más espermatozoides. En los abortos esporádicos, la trisomía se encuentra con mayor frecuencia: el 60 % de todas las mutaciones (más a menudo en el cromosoma 16, así como en 13, 18, 21, 22), en segundo lugar en frecuencia está el síndrome de Shereshevsky-Turner (cromosoma 45 X0) - 20 %, el 15 % restante se explica por la poliploidía (especialmente la triploidía).
En caso de un cambio en el número de cromosomas en un aborto, el examen del cariotipo de los padres generalmente no revela ninguna patología y la probabilidad de una enfermedad cromosómica del feto durante un embarazo posterior es del 1%. Por el contrario, al examinar abortos en parejas con abortos espontáneos habituales, se observan cambios estructurales en los cromosomas (intra e intercromosómicos) en el 3-6% de los casos. Al examinar el cariotipo de los padres, se encuentran reordenamientos cromosómicos equilibrados en el 7% de los casos. En la mayoría de los casos, se trata de translocaciones recíprocas, en las que un segmento de un cromosoma se ubica en el lugar de otro segmento de un cromosoma no homólogo, así como mosaicismo de cromosomas sexuales, inversión y detección de cromosomas en forma de anillo. En caso de presencia de tales reordenamientos en uno de los cónyuges, los procesos de apareamiento y separación de cromosomas se ven obstaculizados durante la meiosis, lo que resulta en la pérdida (deleción) o duplicación (duplicación) de secciones cromosómicas en los gametos. Esto resulta en los llamados reordenamientos cromosómicos desequilibrados, en los cuales el embrión es inviable o sirve como portador de una patología cromosómica grave. La probabilidad de tener un hijo con anomalías cromosómicas desequilibradas en presencia de reordenamientos cromosómicos equilibrados en el cariotipo de uno de los progenitores es del 1 al 15 %. Las diferencias en los datos están asociadas con la naturaleza de los reordenamientos, el tamaño de los segmentos involucrados, el sexo del portador y los antecedentes familiares.
Diagnóstico
Anamnesia
- Enfermedades hereditarias en miembros de la familia.
- Presencia de anomalías congénitas en la familia.
- Nacimiento de niños con retraso mental.
- Presencia de infertilidad y/o aborto de origen desconocido en una pareja casada o en familiares.
- Presencia de casos poco claros de mortalidad perinatal.
Métodos especiales de investigación
- El estudio del cariotipo de los padres está especialmente indicado en parejas casadas ante el nacimiento de un recién nacido con defectos del desarrollo además de antecedentes de aborto, así como en casos de aborto habitual en las primeras etapas del embarazo.
- Análisis citogenético del aborto en casos de muerte fetal o mortalidad neonatal.
Indicaciones de consulta con otros especialistas
Si se detectan cambios en el cariotipo de los padres, es necesaria una consulta con un genetista para evaluar el grado de riesgo de tener un hijo con alguna patología o, en su caso, decidir sobre la donación de óvulos o espermatozoides.
Manejo posterior del paciente
Si una pareja casada tiene un cariotipo patológico, incluso en uno de los padres, se recomienda realizar un diagnóstico prenatal durante el embarazo (biopsia coriónica o amniocentesis) debido al alto riesgo de trastornos del desarrollo en el feto.
Causas anatómicas del aborto habitual
Las causas anatómicas del aborto espontáneo habitual incluyen:
- anomalías congénitas del desarrollo del útero (duplicación completa del útero; útero bicorne, en silla de montar, unicorne; tabique intrauterino parcial o completo);
- defectos anatómicos adquiridos;
- adherencias intrauterinas (síndrome de Asherman);
- fibromas uterinos submucosos;
- insuficiencia ístmico-cervical.
La frecuencia de anomalías anatómicas en pacientes con abortos espontáneos habituales oscila entre el 10 y el 16 %. La frecuencia de aparición de malformaciones uterinas que pueden provocar aborto (pero no infertilidad) en relación con todas las malformaciones uterinas es la siguiente: útero bicorne (37 %), útero en silla de montar (15 %), tabique intrauterino (22 %), duplicación completa del útero (11 %), útero unicorne (4,4 %).
Diagnóstico del aborto habitual
Anamnesia
En caso de patología anatómica del útero, se observan con mayor frecuencia interrupciones tardías del embarazo y partos prematuros, sin embargo, con la implantación en el tabique intrauterino o cerca del nódulo miomatoso, también son posibles interrupciones tempranas del embarazo.
En la insuficiencia ístmico-cervical el signo patognomónico es la interrupción espontánea del embarazo en el segundo trimestre o el parto prematuro temprano, que ocurre con relativa rapidez y con poco dolor.
En caso de malformaciones del útero, es necesario prestar atención a las indicaciones anamnésicas de la patología del tracto urinario (a menudo acompañan anomalías congénitas del útero) y la naturaleza del desarrollo de la función menstrual (indicaciones de hematómetra con un cuerno rudimentario funcional del útero).
Métodos especiales de examen
- Actualmente, la histerosalpingografía se realiza para establecer un diagnóstico, lo que permite estudiar la forma de la cavidad uterina, identificar la presencia de miomas submucosos, adherencias, septos y determinar la permeabilidad de las trompas de Falopio. Para diagnosticar la patología uterina, es racional realizar la histerosalpingografía en el período entre la menstruación y la ovulación, es decir, en la primera fase del ciclo menstrual después del cese del flujo sanguinolento (día 7-9 del ciclo). Para diagnosticar la insuficiencia ístmico-cervical, el estudio se realiza en la segunda fase del ciclo menstrual (día 18-20) para determinar el estado del orificio cervical interno. Antes de realizar la histerosalpingografía, es necesario descartar enfermedades inflamatorias de los órganos pélvicos o tratarlas.
- La histeroscopia se ha generalizado en los últimos años y se ha convertido en el método de referencia para el diagnóstico de patología intrauterina. Sin embargo, debido a su mayor coste en comparación con la histerosalpingografía, este método se utiliza en mujeres con indicios de patología intrauterina basados en datos ecográficos preliminares. La histeroscopia permite examinar la cavidad uterina, determinar la naturaleza de la patología intrauterina y, si se dispone del equipo necesario (resectoscopio), realizar un tratamiento quirúrgico mínimamente invasivo: extirpación de adherencias, miomas submucosos y pólipos endometriales. Para la extirpación de un tabique intrauterino, se prefiere la histeroresectoscopia con control laparoscópico, que previene la perforación de la pared uterina.
- La ecografía se realiza en la primera fase del ciclo menstrual, lo que permite el diagnóstico presuntivo de mioma uterino submucoso y adherencias intrauterinas, y en la segunda fase del ciclo, para identificar un tabique intrauterino y un útero bicorne. Este método es especialmente importante en las primeras etapas del embarazo, cuando su sensibilidad para diagnosticar estas afecciones es del 100 % y su especificidad del 80 %. Fuera del embarazo, el diagnóstico requiere confirmación adicional mediante otros métodos.
- Autores extranjeros destacan la ventaja de la sonohisterografía (ecografía con un sensor transvaginal y la introducción preliminar de una solución de cloruro de sodio al 0,9 % en la cavidad uterina) sobre la histerosalpingografía, ya que permite el diagnóstico diferencial entre el tabique uterino y el útero bicorne. Con la sonohisterografía, es posible no solo estudiar la forma de la cavidad uterina, sino también determinar la configuración del fondo uterino. En nuestro país, este método no se ha generalizado.
- En algunos casos complejos, se utiliza la resonancia magnética de los órganos pélvicos para confirmar el diagnóstico. Este método permite obtener información valiosa en caso de anomalías del desarrollo uterino acompañadas de una disposición atípica de los órganos en la pelvis. La resonancia magnética es importante en caso de un cuerno uterino rudimentario para decidir si es aconsejable extirparlo. La necesidad de extirpar el cuerno uterino rudimentario surge cuando su conexión con la trompa y el ovario impide la formación y el desarrollo del óvulo fecundado. La interrupción del embarazo en caso de anomalías anatómicas del útero puede estar asociada con la implantación fallida del óvulo fecundado (en el tabique intrauterino, cerca del nódulo mioma submucoso), una vascularización y recepción endometrial insuficientemente desarrolladas, relaciones espaciales estrechas en la cavidad uterina (por ejemplo, en caso de deformación de la cavidad por un nódulo mioma), a menudo acompañadas de ICI, y trastornos hormonales.
Tratamiento del aborto habitual
Tratamiento quirúrgico
En presencia de un tabique intrauterino, miomas submucosos y adherencias, el tratamiento quirúrgico más eficaz es la histeroresectoscopia. La frecuencia de abortos espontáneos posteriores en este grupo de mujeres después del tratamiento es del 10 %, en comparación con el 90 % antes de la cirugía. Al comparar los resultados de la metroplastia realizada por laparotomía y la histeroresectoscopia transcervical, P. Heinonen (1997) obtuvo resultados que indican un menor traumatismo y una mayor eficacia de la histeroresectoscopia; el porcentaje de embarazos con hijos viables fue del 68 % y el 86 %, respectivamente.
La extirpación quirúrgica del tabique intrauterino, las adherencias y los miomas submucosos elimina el aborto espontáneo en el 70-80% de los casos. Sin embargo, es ineficaz en mujeres con malformaciones uterinas que han tenido partos normales con abortos recurrentes posteriores. Es probable que en estos casos el factor anatómico no sea la causa principal, y es necesario buscar otras causas de aborto espontáneo.
Se ha demostrado que la metroplastia abdominal se asocia con un riesgo significativo de infertilidad postoperatoria y no mejora el pronóstico de embarazos posteriores. Por lo tanto, es preferible dar preferencia a la histeroscopia y las intervenciones laparoscópicas.
Tratamiento farmacológico
No se ha demostrado la eficacia de la inserción del DIU, las dosis altas de fármacos estrogénicos ni la inserción de una sonda Foley en la cavidad uterina tras operaciones para eliminar adherencias o el tabique intrauterino. Se recomienda planificar el embarazo no antes de los 3 meses posteriores a la operación. Para mejorar el crecimiento del endometrio, se realiza terapia hormonal cíclica durante 3 ciclos menstruales [14]. Durante 3 meses, en los primeros 14 días del ciclo, se recomienda tomar un medicamento que contenga 2 mg de 17-beta-estradiol; en los 14 días siguientes, 2 mg de 17-beta-estradiol y 20 mg de didrogesterona (10 mg de didrogesterona como parte de un medicamento combinado más 10 mg de didrogesterona en un comprimido aparte).
Manejo posterior del paciente
Características del curso del embarazo con útero bicorne o duplicación del útero (cuando hay 2 cavidades uterinas):
- en las primeras etapas del embarazo, a menudo se produce sangrado del cuerno "vacío" o de la cavidad uterina debido a una reacción decidual pronunciada; la táctica en este caso debe ser conservadora y consistir en el uso de agentes antiespasmódicos y hemostáticos;
- amenaza de interrupción del embarazo en diversas etapas;
- desarrollo de insuficiencia ístmico-cervical;
- Retraso del crecimiento intrauterino debido a insuficiencia placentaria.
En las primeras fases del embarazo, en caso de sangrado, se aconseja reposo en cama y semicama, así como la administración de fármacos hemostáticos, antiespasmódicos y sedantes, y terapia con gestágenos (didrogesterona en dosis diaria de 20 a 40 mg) hasta las 16-18 semanas de gestación.
Causas endocrinas del aborto habitual
Según diversos autores, las causas endocrinas del aborto espontáneo representan entre el 8 y el 20 %. Entre estas, las más importantes son la deficiencia de la fase lútea (DLP), la hipersecreción de LH, la disfunción tiroidea y la diabetes mellitus.
La enfermedad tiroidea grave o la diabetes mellitus pueden provocar abortos espontáneos repetidos. Sin embargo, en la diabetes mellitus compensada, el riesgo de abortos espontáneos habituales no difiere del de la población general.
Al mismo tiempo, la alta incidencia de hipotiroidismo en la población requiere un cribado con medición de los niveles de TSH. En pacientes con aborto espontáneo habitual, se observa insuficiencia de la fase lútea en el 20-60% de los casos, y signos ecográficos de ovarios poliquísticos, en el 44-56%. Según la literatura, la influencia de los trastornos hormonales individuales en la formación del complejo sintomático del aborto espontáneo habitual sigue siendo controvertida. Los estudios de M. Ogasawara et al. (1997) no revelaron diferencias fiables en la frecuencia de interrupción del embarazo con y sin LPI en pacientes con dos o más abortos espontáneos previos en la anamnesis, excluyendo causas autoinmunes, anatómicas e infecciosas.
La insuficiencia de la función del cuerpo lúteo puede ser el resultado de una serie de factores desfavorables:
- alteraciones en la secreción de FSH y LH en la primera fase del ciclo menstrual;
- pico temprano o, por el contrario, demasiado tardío de liberación de LH;
- Hipoestrogenismo como consecuencia de una foliculogénesis inadecuada. Todas estas afecciones no se pueden corregir mediante terapia de reemplazo con gestágenos en el período posovulatorio. Estudios prospectivos realizados por L. Regan et al. mostraron un aumento significativo en la frecuencia de abortos espontáneos en pacientes con hipersecreción de LH en el octavo día del ciclo menstrual, en comparación con mujeres con niveles normales de LH en sangre (65 % y 12 % de abortos espontáneos, respectivamente). El efecto perjudicial de un aumento prematuro de LH se asocia con la reanudación prematura de la segunda división meiótica y la ovulación de un óvulo inmaduro, así como con la inducción de la producción de andrógenos por las células de la teca, junto con la recepción endometrial deficiente debido a la insuficiencia de gestágenos. Sin embargo, la reducción preliminar de los niveles de LH preovulatoria con agonistas de la hormona liberadora de gonadotropina sin medidas adicionales destinadas a prolongar el embarazo posterior no proporciona la reducción esperada en la frecuencia de abortos espontáneos.
El estándar de oro para diagnosticar NLF es el examen histológico del material obtenido de la biopsia endometrial en la segunda fase del ciclo durante 2 ciclos menstruales.
El diagnóstico de otras causas de disfunción ovulatoria, como hiperprolactinemia, hipotiroidismo, exceso funcional de andrógenos (ováricos o suprarrenales), debe ir acompañado de la prescripción de un tratamiento adecuado.
Diagnóstico
Historia y examen físico
- Historia. Factores a considerar: menarquia tardía, ciclo menstrual irregular (oligomenorrea, amenorrea, aumento repentino de peso, pérdida de peso, infertilidad, abortos espontáneos tempranos habituales).
- Examen: tipo corporal, altura, peso corporal, hirsutismo, severidad de características sexuales secundarias, presencia de estrías, examen de glándulas mamarias para galactorrea.
- Pruebas diagnósticas funcionales: medición de la temperatura rectal durante 3 ciclos menstruales.
Métodos especiales de investigación
- Estudio hormonal:
- en la 1ª fase del ciclo menstrual (7–8º día) – determinación del contenido de FSH, LH, prolactina, TSH, testosterona, 17-hidroxiprogesterona (17-OP), DHEAS;
- en la 2ª fase del ciclo menstrual (21-22 días) – determinación del contenido de progesterona (los indicadores normativos de los niveles de progesterona son muy variables, el método no se puede utilizar sin tener en cuenta otros factores).
- Ultrasonido:
- en la 1ª fase del ciclo menstrual (5–7º día) – diagnóstico de patología endometrial, ovarios poliquísticos;
- en la segunda fase del ciclo menstrual (20-21 días) – medición del grosor del endometrio (normalmente 10-11 mm, se correlaciona con el contenido de progesterona).
- Se realiza una biopsia endometrial para verificar el NLF 2 días antes de la menstruación prevista (el día 26 en un ciclo de 28 días). Este método se utiliza en casos donde el diagnóstico es incierto. Para estudiar los cambios en el endometrio durante el período denominado "ventana de implantación", se realiza una biopsia el sexto día después de la ovulación.
Tratamiento
Al diagnosticar NLF (según los gráficos de temperatura rectal, la duración de la segunda fase es menor a 11 días, se observa un aumento gradual de la temperatura, una transformación secretora insuficiente del endometrio según los datos de la biopsia endometrial, niveles bajos de progesterona en el suero sanguíneo), es necesario identificar la causa de tales trastornos.
Si el NLF se acompaña de hiperprolactinemia, se realiza una resonancia magnética cerebral. Un método alternativo es la radiografía de cráneo (silla turca).
La primera etapa de la hiperprolactinemia consiste en descartar un adenoma hipofisario, que requiere tratamiento quirúrgico. En ausencia de cambios significativos, la hiperprolactinemia se considera funcional y se prescribe tratamiento con bromocriptina para normalizar los niveles de prolactina. La dosis inicial de bromocriptina es de 1,25 mg/día durante 2 semanas. Tras monitorizar los niveles de prolactina, si los indicadores no se normalizan, la dosis se aumenta a 2,5 mg/día. Ante un aumento significativo de los niveles de prolactina, la dosis inicial es de 2,5 mg/día. En caso de embarazo, se debe suspender la bromocriptina.
Si se detecta hipotiroidismo, se determina la naturaleza de la patología tiroidea junto con un endocrinólogo. En cualquier caso, se indica un tratamiento diario con levotiroxina sódica, cuya dosis se ajusta individualmente hasta que se normalice el nivel de TSH. Si se produce un embarazo, se debe continuar el tratamiento con levotiroxina sódica. La conveniencia de aumentar la dosis durante el primer trimestre del embarazo se decide junto con un endocrinólogo tras obtener los resultados de un análisis hormonal (nivel de TSH, tiroxina libre).
La corrección del NLF se realiza de dos maneras: la primera es la estimulación de la ovulación y la segunda, la terapia de reemplazo con preparados de progesterona.
La primera opción de tratamiento es la estimulación de la ovulación con citrato de clomifeno. Este método de tratamiento se basa en que la mayoría de los trastornos de la fase lútea se presentan en la fase folicular del ciclo. La disminución constante de los niveles de progesterona en la segunda fase es consecuencia de una foliculogénesis deficiente en la primera fase del ciclo. Este trastorno se corregirá con mayor éxito con dosis bajas de citrato de clomifeno en la fase folicular temprana que con la prescripción de progesterona en la segunda fase del ciclo.
En el primer ciclo, la dosis de citrato de clomifeno es de 50 mg/día del quinto al noveno día del ciclo menstrual. La eficacia se controla mediante gráficos de temperatura rectal, mediciones del nivel de progesterona en la segunda fase del ciclo o ecografía dinámica. Si no se observa un efecto suficiente en el segundo ciclo de estimulación de la ovulación, se debe aumentar la dosis de citrato de clomifeno a 100 mg/día del quinto al noveno día del ciclo. La dosis máxima posible en el tercer ciclo de estimulación de la ovulación es de 150 mg/día. Este aumento de la dosis solo es posible si el fármaco se tolera bien (sin dolor intenso en la parte baja del abdomen ni en la espalda baja, ni otros signos de hiperestimulación ovárica).
La segunda opción de tratamiento es la terapia de reemplazo con preparados de progesterona, que promueven la transformación secretora completa del endometrio y proporcionan el efecto necesario en pacientes con abortos espontáneos habituales con ovulación preservada. Además, en los últimos años se ha demostrado que la administración de preparados de progesterona no solo tiene un efecto hormonal, sino también inmunomodulador, suprimiendo las reacciones de rechazo de las células inmunocompetentes del endometrio. En particular, se ha descrito un efecto similar con la dihidrogesterona a una dosis de 20 mg/día. Para la terapia de reemplazo, se utiliza didrogesterona a una dosis de 20 mg/día por vía oral o progesterona micronizada por vía vaginal a una dosis de 200 mg/día. El tratamiento se realiza el segundo día después de la ovulación (el día después del aumento de la temperatura rectal) y se continúa durante 10 días. Si se produce un embarazo, se debe continuar el tratamiento con preparados de progesterona.
Las investigaciones modernas no han confirmado la eficacia de la gonadotropina coriónica humana en el tratamiento del aborto recurrente.
En pacientes con hiperandrogenismo (génesis ovárica o suprarrenal) y abortos espontáneos habituales, el tratamiento farmacológico está indicado debido al efecto de los andrógenos en la ovulación completa y el estado del endometrio. En caso de alteración de la biosíntesis de andrógenos suprarrenales, es posible que su efecto virilizante en el feto femenino, por lo que se realiza terapia con esteroides para proteger al feto.
Hiperandrogenismo de génesis ovárica (ovarios poliquísticos)
Resultados de la historia clínica, el examen físico y los exámenes especiales
- Antecedentes: menarquia tardía, trastornos del ciclo menstrual como oligomenorrea (generalmente primaria, con menos frecuencia secundaria). Los embarazos son poco frecuentes, generalmente interrumpidos espontáneamente en el primer trimestre, con largos periodos de infertilidad entre embarazos.
- Examen: hirsutismo, acné, estrías, índice de masa corporal alto (opcional).
- Gráficos de temperatura rectal: ciclos anovulatorios se alternan con ciclos con ovulación y NLF.
- Examen hormonal: niveles elevados de testosterona, niveles de FSH y LH pueden estar elevados, relación LH/FSH mayor a 3. Ecografía: ovarios poliquísticos.
Tratamiento
Tratamiento sin medicamentos
Pérdida de peso: terapia dietética, actividad física.
Tratamiento farmacológico
- Orlistat en dosis de 120 mg con cada comida principal. La duración del tratamiento se determina teniendo en cuenta el efecto y la tolerabilidad.
- Reducción preliminar de testosterona con preparaciones que contienen acetato de ciproterona (2 mg) y EE (35 mcg) durante 3 ciclos menstruales.
- Suspensión de la anticoncepción, apoyo hormonal de la segunda fase del ciclo (terapia con progestágenos): didrogesterona en dosis de 20 mg/día del día 16 al 25 del ciclo menstrual. Si no hay ovulación espontánea, se pasa a la siguiente etapa.
- Estimulación de la ovulación con citrato de clomifeno a dosis inicial de 50 mg/día del 5º al 9º día del ciclo menstrual con terapia simultánea con gestágenos (didrogesterona a dosis de 20 mg/día del 16º al 25º día del ciclo) y dexametasona (0,5 mg).
- En ausencia de embarazo, la dosis de citrato de clomifeno se aumenta a 100-150 mg/día con la administración de gestágenos en la segunda fase del ciclo y dexametasona (0,5 mg). Se ha establecido que, aunque la dexametasona solo reduce el nivel de andrógenos suprarrenales, la ovulación y la concepción son significativamente más frecuentes con el tratamiento con citrato de clomifeno y dexametasona que con el uso de citrato de clomifeno solo [12].
- Se realizan tres ciclos de estimulación de la ovulación, tras lo cual se recomienda un descanso de tres ciclos menstruales con apoyo gestágeno y decisión de tratamiento quirúrgico mediante acceso laparoscópico (resección en cuña de los ovarios, vaporización láser).
Manejo posterior del paciente
El manejo del embarazo debe ir acompañado de apoyo gestágeno hasta las 16 semanas de gestación (didrogesterona a una dosis de 20 mg/día o progesterona micronizada a una dosis de 200 mg/día). La dexametasona se prescribe solo durante el primer trimestre del embarazo. El seguimiento es fundamental para el diagnóstico oportuno de la insuficiencia ístmico-cervical y, de ser necesario, su corrección quirúrgica.
Hiperandrogenismo suprarrenal (síndrome adrenogenital puberal y pospuberal)
El síndrome adrenogenital (SGA) es una enfermedad hereditaria asociada a una alteración en la síntesis de hormonas de la corteza suprarrenal debido a daños en los genes responsables de la síntesis de diversos sistemas enzimáticos. La enfermedad se hereda de forma autosómica recesiva, con la transmisión de genes mutantes de ambos progenitores, quienes son portadores sanos.
En el 90% de los casos, el síndrome adrenogenital es causado por mutaciones en el gen CYP21B, lo que provoca una alteración en la síntesis de 21-hidroxilasa.
Resultados de la historia clínica, el examen físico y los exámenes especiales
- Historia: menarquia tardía, ciclo menstrual ligeramente prolongado, posible oligomenorrea, abortos espontáneos en el primer trimestre, posible infertilidad.
- Examen: acné, hirsutismo, tipo de cuerpo androide (hombros anchos, pelvis estrecha), hipertrofia del clítoris.
- Gráficos de temperatura rectal: ciclos anovulatorios se alternan con ciclos con ovulación y NLF.
- Prueba hormonal: niveles elevados de 17-OP, DHEAS.
- Ecografía: los ovarios no presentan cambios.
Un signo patognomónico fuera del embarazo es el aumento de la concentración de 17-OP en el plasma sanguíneo.
Actualmente, se utiliza una prueba con ACTH para diagnosticar la forma latente no clásica del hiperandrogenismo suprarrenal. Para esta prueba se utiliza Synacthen, un polipéptido sintético con las propiedades de la ACTH endógena, es decir, que estimula las fases iniciales de la síntesis de hormonas esteroides a partir del colesterol en las glándulas suprarrenales.
Prueba de Synacthen (un análogo de ACTH): Se inyecta 1 ml (0,5 mg) de Synacthen por vía subcutánea en el hombro. El contenido inicial de 17-OP y cortisol se determina primero en una muestra de plasma sanguíneo de 9 horas tomada por la mañana. Se toma una muestra de sangre de control 9 horas después de la inyección para determinar el nivel de 17-OP y cortisol. El índice de determinación (D) se calcula mediante la fórmula:
D = 0,052 × 17-OP + 0,005 × Cortisol/17-OP - 0,018 × Cortisol/17-OP
Si el coeficiente D es menor o igual a 0,069, indica la ausencia de hiperandrogenismo suprarrenal. Si el coeficiente D es mayor a 0,069, se debe considerar que el hiperandrogenismo se debe a una disfunción de las glándulas suprarrenales.
Tratamiento farmacológico
El pilar del tratamiento del hiperandrogenismo debido a la deficiencia de 21-hidroxilasa son los glucocorticoides, que se utilizan para suprimir la secreción excesiva de andrógenos.
Manejo posterior del paciente
Debido al efecto virilizante de los andrógenos maternos en el feto, con diagnóstico establecido de hiperandrogenismo suprarrenal, se prescribe tratamiento con dexametasona a una dosis inicial de 0,25 mg antes del embarazo y se continúa con una dosis individualizada (de 0,5 a 1 mg) durante todo el embarazo. En una mujer con abortos espontáneos frecuentes y que padece hiperandrogenismo suprarrenal, no es apropiado suspender el tratamiento, ya que la frecuencia de abortos espontáneos sin tratamiento alcanza el 14%, y con la continuación del tratamiento, el 9%.
Considerando que las pacientes con síndrome adrenogenital pueden transmitir este gen al feto, es necesario realizar diagnóstico prenatal: entre las semanas 17 y 18 de embarazo, se prescribe un análisis de sangre para determinar el contenido de 17-OP en la madre. Si el nivel de la hormona en sangre aumenta, se determina su concentración en el líquido amniótico. Si el contenido de 17-OP en el líquido amniótico aumenta, se diagnostica síndrome adrenogenital en el feto. Desafortunadamente, es imposible determinar la gravedad del síndrome adrenogenital (leve o grave con pérdida de sal) mediante el nivel de 17-OP en el líquido amniótico. La decisión sobre la continuación del embarazo en esta situación la toman los padres.
Si el padre del niño es portador del gen del síndrome adrenogenital y se han dado casos familiares de niños con este síndrome, el paciente, incluso sin hiperandrogenismo suprarrenal, recibe dexametasona por el bien del feto (para prevenir la virilización del feto femenino) a una dosis de 20 mcg/kg de peso corporal, máximo 1,5 mg/día en 2-3 dosis después de las comidas. A las 17-18 semanas, tras determinar el sexo del feto y la expresión del gen del síndrome adrenogenital (según los resultados de la amniocentesis), el tratamiento continúa hasta el final del embarazo si el feto es una niña con síndrome adrenogenital. Si el feto es un niño o una niña que no es portador del gen del síndrome adrenogenital, se puede suspender la dexametasona.
Si una mujer con abortos espontáneos frecuentes padece hiperandrogenismo suprarrenal, el tratamiento con dexametasona se mantiene durante todo el embarazo y se suspende solo después del parto. Al tercer día después del parto, la dosis de dexametasona se reduce gradualmente (0,125 mg cada 3 días) hasta su suspensión completa en el posparto.
Hiperandrogenismo de génesis mixta (ovárica y suprarrenal)
Resultados de la historia clínica, el examen físico y los exámenes especiales
- Antecedentes: menarquia tardía, trastornos del ciclo menstrual como oligomenorrea (generalmente primaria, con menos frecuencia secundaria), amenorrea, posibles lesiones, conmociones cerebrales. Los embarazos son poco frecuentes, generalmente interrumpidos espontáneamente en el primer trimestre, con largos periodos de infertilidad entre embarazos.
- Examen físico: hirsutismo, acné, estrías, acantosis nigricans, índice de masa corporal elevado, hipertensión.
- Gráficos de temperatura rectal: ciclos anovulatorios se alternan con ciclos con ovulación y NLF.
- Examen hormonal: niveles elevados de testosterona, niveles de FSH y LH pueden estar elevados, relación LH/FSH mayor de 3, niveles elevados de DHEAS, 17-OP, puede estar presente hiperprolactinemia.
- Ecografía: ovarios poliquísticos.
- Electroencefalografía: cambios en la actividad bioeléctrica del cerebro.
- Hiperinsulinemia, trastorno del metabolismo lipídico (colesterol alto, lipoproteínas de baja densidad y lipoproteínas de muy baja densidad), disminución de la tolerancia a la glucosa o niveles elevados de glucosa en sangre.
Tratamiento
Tratamiento sin medicamentos
Pérdida de peso (dieta baja en calorías, actividad física).
Tratamiento farmacológico
Primera etapa: en presencia de resistencia a la insulina, se recomienda prescribir metformina en una dosis diaria de 1000-1500 mg para aumentar la sensibilidad a la insulina.
Segunda etapa: en caso de trastornos graves del ciclo menstrual y niveles altos de testosterona, se recomienda prescribir medicamentos con efecto antiandrogénico que contengan acetato de ciproterona (2 mg) y etinilestradiol (35 mcg) durante 3 meses.
La tercera etapa es la estimulación de la ovulación seguida de apoyo gestágeno (el esquema se describe más arriba) y la toma de dexametasona en dosis diaria de 0,25-0,5 mg.
En caso de hiperprolactinemia e hipotiroidismo, se debe realizar una corrección farmacológica adecuada en los ciclos de estimulación de la ovulación. Si se produce un embarazo, se debe suspender la bromocriptina y continuar con la levotiroxina.
Si la estimulación de la ovulación no es eficaz, se debe decidir la prescripción de inductores directos de la ovulación, la conveniencia del tratamiento quirúrgico de los ovarios poliquísticos o la fertilización in vitro.
Manejo posterior del paciente
En pacientes con síndrome metabólico, el embarazo suele complicarse con hipertensión arterial, nefropatía e hipercoagulabilidad, por lo que es necesario controlar la presión arterial y realizar hemostasiogramas desde las primeras etapas del embarazo y corregir los trastornos emergentes (si es necesario) con antihipertensivos, antiagregantes plaquetarios y anticoagulantes. Se prescriben fármacos gestagénicos hasta las 16 semanas de embarazo: didrogesterona a una dosis de 20 mg/día o progesterona micronizada a una dosis de 200 mg/día en 2 dosis.
Todas las mujeres con hiperandrogenismo representan un grupo de riesgo para el desarrollo de insuficiencia ístmico-cervical. El control del estado del cuello uterino debe realizarse a partir de la semana 16 de embarazo y, de ser necesario, se debe realizar una corrección quirúrgica de la insuficiencia ístmico-cervical.
Causas inmunológicas del aborto habitual
Actualmente se sabe que aproximadamente el 80% de los casos de abortos repetidos sin explicación previa (tras descartar causas genéticas, anatómicas y hormonales) se asocian con trastornos inmunitarios. Se distinguen entre trastornos autoinmunes y aloinmunes, que conducen a abortos espontáneos habituales.
En los procesos autoinmunes, los propios tejidos del sistema inmunitario se convierten en blanco de la agresión, es decir, la respuesta inmunitaria se dirige contra sus propios antígenos. En esta situación, el feto sufre secundariamente como consecuencia del daño a los tejidos de la madre.
En los trastornos aloinmunes, la respuesta inmunitaria de la mujer se dirige contra los antígenos embrionarios/fetales recibidos del padre y que son potencialmente extraños al cuerpo de la madre.
Los trastornos autoinmunitarios más frecuentes en pacientes con aborto espontáneo habitual incluyen la presencia de autoanticuerpos antifosfolípidos, antitiroideos y antinucleares en suero. Así, se ha establecido que el 31 % de las mujeres con aborto espontáneo habitual fuera del embarazo presentan autoanticuerpos contra la tiroglobulina y la peroxidasa tiroidea (autoanticuerpos microsomales tiroideos [peroxidasa tiroidea]); en estos casos, el riesgo de aborto espontáneo en el primer trimestre del embarazo aumenta al 20 %. En el aborto espontáneo habitual, la presencia de anticuerpos antinucleares y antitiroideos indica la necesidad de realizar pruebas adicionales para identificar el proceso autoinmunitario y confirmar el diagnóstico.
El síndrome antifosfolípido (SAF) sigue siendo una enfermedad autoinmune generalmente reconocida que conduce a la muerte del embrión y el feto.
Trastornos aloinmunes
En la actualidad, los procesos aloinmunes que conducen al rechazo fetal incluyen la presencia de un número aumentado (más de 3) de antígenos comunes del sistema del complejo mayor de histocompatibilidad en los cónyuges (observado a menudo en matrimonios consanguíneos); niveles bajos de factores bloqueantes en el suero de la madre; niveles aumentados de células asesinas naturales (células NK CD56, CD16) en el endometrio y la sangre periférica de la madre tanto fuera como durante el embarazo; niveles elevados de concentración de una serie de citocinas en el endometrio y el suero sanguíneo, en particular, interferón γ, factor de necrosis tumoral a, interleucinas-1 y 2.
Actualmente, se están estudiando los factores aloinmunes que provocan abortos precoces y las formas de corregir estas afecciones. No existe consenso sobre los métodos terapéuticos. Según algunos investigadores, la inmunización activa con linfocitos de donantes no produce un efecto significativo, mientras que otros autores describen un efecto positivo significativo con dicha inmunización y el tratamiento con inmunoglobulinas.
Actualmente, uno de los agentes inmunomoduladores al inicio del embarazo es la progesterona. En particular, estudios han demostrado el papel de la didrogesterona en una dosis diaria de 20 mg en mujeres con abortos espontáneos frecuentes durante el primer trimestre del embarazo, con un aumento en el nivel de células CD56 en el endometrio.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Trombofilias determinadas genéticamente
Las siguientes formas de trombofilias determinadas genéticamente se consideran afecciones trombofílicas durante el embarazo que conducen a abortos espontáneos habituales.
- Deficiencia de antitrombina III.
- Mutación del factor V (mutación de Leiden).
- Deficiencia de proteína C.
- Deficiencia de proteína S.
- Mutación del gen de la protrombina G20210A.
- Hiperhomocisteinemia.
El examen para identificar causas raras de trombofilia es necesario en los casos en que haya:
- Antecedentes familiares: tromboembolismo antes de los 40 años en familiares;
- episodios confiables de trombosis venosa y/o arterial antes de los 40 años;
- trombosis recurrente en el paciente y familiares inmediatos;
- complicaciones tromboembólicas durante el embarazo y después del parto al utilizar anticonceptivos hormonales;
- pérdidas repetidas de embarazos, muerte fetal, retraso del crecimiento intrauterino, desprendimiento de placenta;
- preeclampsia de aparición temprana, síndrome HELLP.
Causas infecciosas del aborto habitual
El papel del factor infeccioso como causa del aborto espontáneo habitual es ampliamente debatido en la actualidad. Se sabe que la primoinfección en las primeras etapas del embarazo puede causar daño embrionario incompatible con la vida, lo que conduce a abortos espontáneos esporádicos. Sin embargo, la probabilidad de reactivación de la infección simultáneamente con abortos repetidos es insignificante. Además, hasta la fecha no se han encontrado microorganismos que provoquen abortos espontáneos habituales. Estudios realizados en los últimos años han demostrado que la mayoría de las mujeres con abortos espontáneos habituales y endometritis crónica presentan una prevalencia de 2 a 3 o más tipos de microorganismos anaerobios obligados y virus en el endometrio.
Según VM Sidelnikova et al., en mujeres que sufren abortos espontáneos habituales, el diagnóstico de endometritis crónica fuera del embarazo se verificó histológicamente en el 73,1% de los casos y en el 86,7%, se observó persistencia de microorganismos oportunistas en el endometrio, lo que ciertamente puede ser la causa de la activación de procesos inmunopatológicos. La infección viral persistente mixta (virus del herpes simple, Coxsackie A, Coxsackie B, enterovirus 68-71, citomegalovirus) se encuentra en pacientes con abortos espontáneos habituales significativamente más a menudo que en mujeres con antecedentes obstétricos normales. K. Kohut et al. (1997) demostraron que el porcentaje de cambios inflamatorios en el endometrio y el tejido decidual en pacientes con abortos espontáneos recurrentes primarios es significativamente mayor que en mujeres después de un aborto espontáneo con antecedentes de al menos un parto a término.
La colonización bacteriana y viral del endometrio suele deberse a la incapacidad del sistema inmunitario y de las defensas inespecíficas del organismo (sistema del complemento, fagocitosis) para eliminar por completo el agente infeccioso. Al mismo tiempo, su propagación se ve limitada por la activación de los linfocitos T (células T auxiliares, linfocitos T citotóxicos) y los macrófagos. En todos los casos mencionados, se produce la persistencia de microorganismos, caracterizada por la atracción de fagocitos mononucleares, linfocitos T citotóxicos y linfocitos T auxiliares, que sintetizan diversas citocinas, al foco de inflamación crónica. Al parecer, este estado del endometrio impide la inmunosupresión local en el período preimplantacional, necesaria para formar una barrera protectora y prevenir el rechazo de un feto semi-extraño.
En este sentido, antes del embarazo, a las mujeres con abortos espontáneos frecuentes se les debe diagnosticar endometritis crónica. Para confirmar o descartar este diagnóstico, se realiza una biopsia endometrial entre el séptimo y el octavo día del ciclo menstrual, con examen histológico, PCR y análisis bacteriológico del material de la cavidad uterina. Tras confirmar el diagnóstico, la endometritis crónica se trata según las normas para el tratamiento de enfermedades inflamatorias de los órganos pélvicos.

