Médico experto del artículo.
Nuevos artículos
Glándulas paratiroides
Último revisado: 04.07.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
En 1879, el científico sueco S. Sandström describió las glándulas paratiroides en humanos y les dio un nombre. Las glándulas paratiroides son órganos vitales. Su función es producir y secretar la hormona paratiroidea (PTH), uno de los principales reguladores del metabolismo del calcio y el fósforo.
Las glándulas paratiroides superior e inferior son cuerpos redondos u ovoides ubicados en la superficie posterior de cada lóbulo de la glándula tiroides: una en la parte superior y la otra en la inferior. Cada glándula mide de 4 a 8 mm de largo, de 3 a 4 mm de ancho y de 2 a 3 mm de grosor. Su número varía entre 2 y 7 u 8; en promedio, hay cuatro. Su masa total es de 1,18 g.
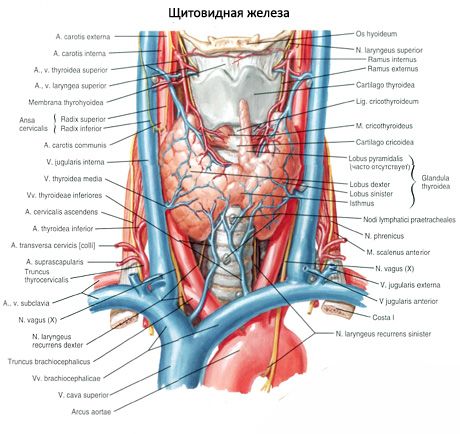
Las glándulas paratiroides se diferencian de la glándula tiroides por su color más claro (en niños son de color rosa pálido, en adultos, de color marrón amarillento). A menudo, se ubican en el punto de penetración del tejido tiroideo por las arterias tiroideas inferiores o sus ramas. Están separadas de los tejidos circundantes por su propia cápsula fibrosa, desde la cual se extienden capas de tejido conectivo hacia las glándulas. Estas últimas contienen una gran cantidad de vasos sanguíneos y dividen las glándulas paratiroides en grupos de células epiteliales.
El parénquima glandular está formado por los paratirocitos principales y acidófilos, que forman cordones y racimos rodeados de finos haces de fibras de tejido conectivo. Ambos tipos de células se consideran etapas diferentes del desarrollo de los paratirocitos. Los paratirocitos principales tienen forma poliédrica, citoplasma basófilo y una gran cantidad de ribosomas. Entre estas células, se distinguen las oscuras (de secreción activa) y las claras (menos activas). Los paratirocitos acidófilos son grandes, de contornos definidos y contienen numerosas mitocondrias pequeñas con partículas de glucógeno.
La hormona de las glándulas paratiroides, la paratiroxina (hormona paratiroidea), es proteica y participa en la regulación del metabolismo fósforo-calcio. La hormona paratiroidea reduce la excreción de calcio en la orina y aumenta su absorción intestinal en presencia de vitamina D. La tirocalcitonina es un antagonista de la hormona paratiroidea.
Embriogénesis de las glándulas paratiroides
Las glándulas paratiroides se desarrollan a partir del epitelio de las bolsas branquiales pares III y IV. En la séptima semana de desarrollo, los rudimentos epiteliales de los cuerpos se separan de las paredes de las bolsas branquiales y, durante el crecimiento, se desplazan caudalmente. Posteriormente, las glándulas paratiroides en formación ocupan una posición permanente en las superficies posteriores de los lóbulos derecho e izquierdo de la glándula tiroides.
 [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
[ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
Vasos y nervios de las glándulas paratiroides
El riego sanguíneo de las glándulas paratiroides proviene de las ramas de las arterias tiroideas superior e inferior, así como de las ramas esofágica y traqueal. La sangre venosa fluye a través de las venas del mismo nombre. La inervación de las glándulas paratiroides es similar a la de la glándula tiroides.
Características de las glándulas paratiroides relacionadas con la edad
La masa total de las glándulas paratiroides en un recién nacido fluctúa entre 6 y 9 mg. Durante el primer año de vida, su masa total se triplica, a los 5 años se duplica y a los 10 años se triplica. Después de los 20 años, la masa total de las cuatro glándulas paratiroides alcanza los 120-140 mg y se mantiene constante hasta la vejez. A todas las edades, la masa de las glándulas paratiroides en las mujeres es ligeramente mayor que en los hombres.
Generalmente, una persona tiene dos pares de glándulas paratiroides (superior e inferior), ubicadas en la superficie posterior de la glándula tiroides, fuera de su cápsula, cerca de los polos superior e inferior. Sin embargo, el número y la ubicación de las glándulas paratiroides pueden variar; en ocasiones se encuentran hasta 12. Pueden ubicarse en el tejido de las glándulas tiroides y timo, en el mediastino anterior y posterior, en el pericardio, detrás del esófago, en la zona de la bifurcación de la arteria carótida. Las glándulas paratiroides superiores tienen forma de ovoide aplanado, mientras que las inferiores son esféricas. Sus dimensiones son de aproximadamente 6 x 3 a 4 x 1,5 - 3 mm, su peso total es de 0,05 a 0,5 g y su color es rojizo o marrón amarillento. El riego sanguíneo de las glándulas paratiroides se realiza principalmente a través de las ramas de la arteria tiroidea inferior, mientras que el flujo venoso se produce a través de las venas de la glándula tiroides, el esófago y la tráquea. Las glándulas paratiroides están inervadas por fibras simpáticas de los nervios laríngeo recurrente y superior, mientras que la inervación parasimpática la realizan los nervios vagos. Las glándulas paratiroides están cubiertas por una fina cápsula de tejido conectivo; los tabiques que se extienden desde ella penetran en las glándulas. Contienen vasos sanguíneos y fibras nerviosas. El parénquima de las glándulas paratiroides está formado por paratirocitos, o células principales, entre las que, según el grado de tinción, se distinguen células claras o brillantes hormonalmente activas, así como células oscuras en reposo. Las células principales forman racimos, cordones y grupos, y en las personas mayores, folículos con coloide en la cavidad. En adultos, aparecen células, localizadas principalmente en la periferia de las glándulas paratiroides, teñidas con eosina: células eosinofílicas u oxifílicas, que son células principales en degeneración. En las glándulas paratiroides, también se pueden encontrar formas transicionales entre las células principales y las oxifílicas.
Los primeros avances en el esclarecimiento de la síntesis, la decodificación de la estructura y el estudio del metabolismo de la hormona paratiroidea se lograron después de 1972. La hormona paratiroidea es un polipéptido monocatenario de 84 aminoácidos, sin cisteína, con un peso molecular aproximado de 9500 daltons. Se forma en las glándulas paratiroides a partir de un bioprecursor, la hormona proparatiroidea (proPTH), que contiene 6 aminoácidos adicionales en el extremo NH₂ . La proPTH se sintetiza en las células principales de las glándulas paratiroides (en su retículo endoplasmático granular) y, mediante la escisión proteolítica en el aparato de Golgi, se convierte en hormona paratiroidea. Su actividad biológica es significativamente menor que la de la PTH. Aparentemente, la proPTH está ausente en la sangre de personas sanas, pero en condiciones patológicas (con adenoma de las glándulas paratiroides) puede secretarse junto con la PTH. Recientemente, se descubrió un precursor de la proPTH, la preproPTH, que contiene 25 residuos de aminoácidos adicionales en el extremo NH₂. Por lo tanto, la preproPTH contiene 115 residuos de aminoácidos, la proPTH, 90, y la PTH, 84.
La estructura de la hormona paratiroidea bovina y porcina se ha establecido completamente. La hormona paratiroidea humana se ha aislado de adenomas de la glándula paratiroidea, pero su estructura solo se ha descifrado parcialmente. Si bien existen diferencias en la estructura de la hormona paratiroidea, las hormonas paratiroideas animal y humana presentan inmunorreactividad cruzada. El polipéptido que consiste en los primeros 34 residuos de aminoácidos prácticamente conserva la actividad biológica de la hormona natural. Esto nos permite asumir que el casi % restante de la molécula en el extremo carboxilo no está directamente relacionado con los efectos principales de la hormona paratiroidea. El fragmento 1-29 de la hormona paratiroidea también exhibe cierta actividad biológica e inmunológica. El fragmento biológicamente inactivo 53-84 también exhibe un efecto inmunológico, es decir, estas propiedades de la hormona paratiroidea se exhiben en al menos 2 secciones de su molécula.
La hormona paratiroidea que circula en la sangre es heterogénea y difiere de la hormona nativa secretada por las glándulas paratiroideas. Se distinguen al menos tres tipos de hormona paratiroidea en la sangre: hormona paratiroidea intacta, con un peso molecular de 9500 daltons; sustancias biológicamente inactivas de la porción carboxilo de la molécula de hormona paratiroidea, con un peso molecular de 7000 a 7500 daltons; y sustancias biológicamente activas, con un peso molecular aproximado de 4000 daltons.
Se encontraron fragmentos aún más pequeños en sangre venosa, lo que indica que se formaron en la periferia. Los principales órganos donde se formaron fragmentos de hormona paratiroidea fueron el hígado y los riñones. La fragmentación de la hormona paratiroidea en estos órganos aumentó en la patología hepática y la insuficiencia renal crónica (IRC). Bajo estas condiciones, los fragmentos de hormona paratiroidea permanecieron en el torrente sanguíneo significativamente más tiempo que en individuos sanos. El hígado absorbió principalmente la hormona paratiroidea intacta, pero no eliminó los fragmentos de hormona paratiroidea carboxilo-terminal o amino-terminal de la sangre. Los riñones desempeñaron un papel principal en el metabolismo de la hormona paratiroidea. Representaron casi el 60% del aclaramiento metabólico de la hormona inmunorreactiva carboxilo-terminal y el 45% del fragmento amino-terminal de la hormona paratiroidea. La principal área de metabolismo del fragmento amino-terminal activo de la hormona paratiroidea fueron los huesos.
Se detectó secreción pulsátil de hormona paratiroidea, más intensa durante la noche. Tras 3-4 horas de sueño nocturno, su concentración en sangre es entre 2,5 y 3 veces superior a la media diurna.
La función principal de la hormona paratiroidea es mantener la homeostasis del calcio. Al mismo tiempo, el calcio sérico (total y especialmente el ionizado) es el principal regulador de la secreción de la hormona paratiroidea (una disminución en los niveles de calcio estimula la secreción de la hormona paratiroidea, mientras que un aumento la suprime), es decir, la regulación se lleva a cabo según el principio de retroalimentación. En condiciones de hipocalcemia, la conversión de proPTH en hormona paratiroidea aumenta. El contenido de magnesio en la sangre también juega un papel importante en la liberación de la hormona paratiroidea (su nivel elevado estimula, mientras que su nivel reducido suprime la secreción de la hormona paratiroidea). Los principales objetivos de la hormona paratiroidea son los riñones y los huesos esqueléticos, pero es conocido su efecto sobre la absorción de calcio en el intestino, la tolerancia a los carbohidratos, los niveles séricos de lípidos, su papel en el desarrollo de la impotencia, el prurito cutáneo, etc.
Para caracterizar el efecto de la hormona paratiroidea sobre los huesos, es necesario proporcionar una breve información sobre la estructura del tejido óseo, las características de su reabsorción y remodelación fisiológica.
Se sabe que la mayor parte del calcio del cuerpo (hasta el 99%) se encuentra en el tejido óseo. Dado que se encuentra en el hueso en forma de compuestos de fósforo y calcio, el 99% del contenido total de fósforo también se encuentra en los huesos. Su tejido, a pesar de su aparente naturaleza estática, se remodela constantemente, se vasculariza activamente y posee altas propiedades mecánicas. El hueso es un depósito dinámico de fósforo, magnesio y otros compuestos necesarios para mantener la homeostasis del metabolismo mineral. Su estructura incluye componentes minerales densos estrechamente relacionados con la matriz orgánica, compuesta por un 90-95% de colágeno, pequeñas cantidades de mucopolisacáridos y proteínas no colágenas. La parte mineral del hueso está compuesta por hidroxiapatita (su fórmula empírica es Ca₁₄(PO₃)₆(OH)₂) y fosfato de calcio amorfo.
El hueso está formado por osteoblastos que se originan a partir de células mesenquimales indiferenciadas. Estas son células mononucleares que participan en la síntesis de componentes de la matriz ósea orgánica. Se ubican en una monocapa sobre la superficie ósea y están en estrecho contacto con el osteoide. Los osteoblastos son responsables de la deposición de osteoide y su posterior mineralización. El producto de su actividad vital es la fosfatasa alcalina, cuyo contenido en sangre es un indicador indirecto de su actividad. Rodeados de osteoide mineralizado, algunos osteoblastos se transforman en osteocitos (células mononucleares cuyo citoplasma forma canales asociados con los canales de los osteocitos vecinos). No participan en la remodelación ósea, pero sí en el proceso de destrucción perilacunar, importante para la rápida regulación de los niveles de calcio en el suero sanguíneo. La resorción ósea la llevan a cabo los osteoclastos (células polinucleares gigantes), aparentemente formadas por la fusión de macrófagos mononucleares. También se asume que los precursores de los osteoclastos podrían ser células madre hematopoyéticas de la médula ósea. Son móviles, forman una capa en contacto con el hueso, localizada en las zonas de mayor reabsorción. Debido a la liberación de enzimas proteolíticas y fosfatasa ácida, los osteoclastos provocan la degradación del colágeno, la destrucción de la hidroxiapatita y la eliminación de minerales de la matriz. El tejido óseo poco mineralizado (osteoide) recién formado es resistente a la reabsorción osteoclástica. Las funciones de los osteoblastos y los osteoclastos son independientes, pero están coordinadas entre sí, lo que conduce a una remodelación esquelética normal. El crecimiento óseo en longitud depende de la osificación endocondral, mientras que el crecimiento en anchura y grosor depende de la osificación perióstica. Estudios clínicos con 47 Ca han demostrado que hasta el 18 % del contenido total de calcio en el esqueleto se renueva cada año. Cuando los huesos se dañan (fracturas, procesos infecciosos), el hueso alterado se reabsorbe y se forma hueso nuevo.
Los complejos celulares que participan en el proceso local de resorción y formación ósea se denominan unidades básicas de remodelado multicelular (UMB). Regulan la concentración local de calcio, fósforo y otros iones, la síntesis de componentes orgánicos del hueso, en particular el colágeno, su organización y mineralización.
El principal efecto de la hormona paratiroidea en los huesos esqueléticos es potenciar los procesos de resorción, afectando tanto a los componentes minerales como orgánicos de la estructura ósea. La hormona paratiroidea promueve el crecimiento de los osteoclastos y su actividad, lo que se acompaña de un mayor efecto osteolítico y un aumento de la resorción ósea. En este caso, los cristales de hidroxiapatita se disuelven con la liberación de calcio y fósforo a la sangre. Este proceso es el principal mecanismo para aumentar el nivel de calcio en sangre. Consta de tres componentes: movilización del calcio desde el hueso perilacunar (osteocitos profundos); proliferación de células osteoprogeneradoras en osteoclastos; y mantenimiento de un nivel constante de calcio en sangre mediante la regulación de su liberación desde el hueso (osteocitos superficiales).
Así, la hormona paratiroidea aumenta inicialmente la actividad de los osteocitos y osteoclastos, potenciando la osteólisis y provocando un aumento del nivel de calcio en sangre y una mayor excreción de calcio y oxiprolina en la orina. Este es el primer efecto cualitativo y rápido de la hormona paratiroidea. El segundo efecto de la hormona paratiroidea sobre los huesos es cuantitativo. Se asocia con un aumento de la reserva de osteoclastos. Con la osteólisis activa, se produce un estímulo para una mayor proliferación de osteoblastos, activando tanto la resorción como la formación ósea con predominio de la resorción. Con un exceso de hormona paratiroidea, se produce un balance óseo negativo. Esto se acompaña de una excreción excesiva de oxiprolina, un producto de la degradación del colágeno y ácidos siálicos incluidos en la estructura de los mucopolisacáridos. La hormona paratiroidea activa el monofosfato de adenosina cíclico (AMPc). El aumento de la excreción de AMPc en la orina tras la administración de hormona paratiroidea puede servir como indicador de la sensibilidad tisular a esta hormona.
El efecto más importante de la hormona paratiroidea en los riñones es su capacidad para reducir la reabsorción de fósforo, aumentando la fosfaturia. El mecanismo de reducción en diferentes partes de la nefrona es diferente: en la parte proximal, este efecto de la hormona paratiroidea se debe al aumento de la permeabilidad y ocurre con la participación del AMPc, mientras que en la parte distal, no depende del AMPc. El efecto fosfatúrico de la hormona paratiroidea cambia con la deficiencia de vitamina D, la acidosis metabólica y la disminución del contenido de fósforo. Las hormonas paratiroideas aumentan ligeramente la reabsorción tubular total de calcio. Al mismo tiempo, la disminuyen en las partes proximales y la aumentan en las distales. Este último es de importancia dominante: la hormona paratiroidea disminuye el aclaramiento de calcio. La hormona paratiroidea disminuye la reabsorción tubular de sodio y su bicarbonato, lo que puede explicar el desarrollo de acidosis en el hiperparatiroidismo. Aumenta la formación de 1,25-dioxicolecalciferol 1,25(OH₂ ) D₃ en los riñones, la forma activa de la vitamina D₃ . Este compuesto aumenta la reabsorción de calcio en el intestino delgado al estimular la actividad de una proteína transportadora de calcio (CaBP) específica en su pared.
El nivel normal de hormona paratiroidea es, en promedio, de 0,15 a 0,6 ng/ml. Varía según la edad y el sexo. El contenido promedio de hormona paratiroidea en sangre en personas de 20 a 29 años es de (0,245 ± 0,017) ng/ml, y en personas de 80 a 89 años, de (0,545 ± 0,048) ng/ml. El nivel de hormona paratiroidea en mujeres de 70 años es de (0,728 ± 0,051) ng/ml, y en hombres de la misma edad, de (0,466 ± 0,40) ng/ml. Por lo tanto, el contenido de hormona paratiroidea aumenta con la edad, pero en mayor medida en las mujeres.
Como regla general, se deben utilizar varias pruebas diferentes para el diagnóstico diferencial de la hipercalcemia.
Presentamos la clasificación clínica y patogénica desarrollada por nosotros, basada en la clasificación de OV Nikolaev y VN Tarkaeva (1974).
Clasificación clínica y patogénica de las enfermedades asociadas con la secreción alterada de la hormona paratiroidea y la sensibilidad a la misma.
Hiperparatiroidismo primario
- Por patogénesis:
- adenoma(s) hiperfuncionante(s);
- hiperplasia de la OGD;
- carcinoma paratiroideo hiperfuncionante;
- neoplasia endocrina múltiple tipo I con hiperparatiroidismo (síndrome de Wermer);
- Neoplasia endocrina múltiple tipo II con hiperparatiroidismo (síndrome de Sipple).
- Según las características clínicas:
- forma del hueso:
- osteoporótico,
- osteítis fibroquística,
- "Pagetoide";
- forma visceropática:
- con daño predominante en riñones, tracto gastrointestinal, esfera neuropsiquiátrica;
- forma mixta.
- forma del hueso:
- Río abajo:
- picante;
- crónico.
Hiperparatiroidismo secundario (hiperfunción secundaria e hiperplasia de las glándulas paratiroides con hipocalcemia e hiperfosfatemia prolongadas)
- Patología renal:
- insuficiencia renal crónica;
- tubulopatía (tipo Albright-Fanconi);
- raquitismo renal.
- Patología intestinal:
- síndrome de malabsorción.
- Patología ósea:
- osteomalacia senil;
- puerperal;
- idiopático;
- Enfermedad de Paget.
- Deficiencia de vitamina D:
- nefropatía;
- hígado;
- deficiencias enzimáticas hereditarias.
- Enfermedades malignas: mieloma.
Hiperparatiroidismo terciario
- Adenoma(s) de funcionamiento autónomo de las glándulas paratiroides, que se desarrollan en el contexto de un hiperparatiroidismo secundario de larga duración.
Pseudohiperparatiroidismo
- Producción de hormona paratiroidea por tumores de origen no paratiroideo.
Formaciones quísticas y tumorales hormonalmente inactivas de las glándulas paratiroides
- Quiste.
- Tumores o carcinomas hormonalmente inactivos.
Hipoparatiroidismo
- Subdesarrollo congénito o ausencia de las glándulas paratiroides.
- Origen idiopático, autoinmune.
- Postoperatorio, desarrollado en relación con la extirpación de las glándulas paratiroides.
- Postoperatorio por deterioro del aporte sanguíneo y de la inervación.
- Daños por radiación, exógena y endógena (radioterapia externa, tratamiento de enfermedades tiroideas con yodo radiactivo).
- Daño a las glándulas paratiroides debido a hemorragia o infarto.
- Lesiones infecciosas.
Pseudohipoparatiroidismo
- Tipo I: insensibilidad de los órganos diana a la hormona paratiroidea, dependiente de la adenilato ciclasa;
- Tipo II: insensibilidad de los órganos diana a la hormona paratiroidea, independiente de la adenilato ciclasa, posiblemente de origen autoinmune.
Pseudopseudohipoparatiroidismo
Presencia de signos somáticos de pseudohipoparatiroidismo en familiares sanos en familias de pacientes con pseudohipoparatiroidismo sin trastornos bioquímicos característicos y sin tetania.
 [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]

