Médico experto del artículo.
Nuevos artículos
Glioma cerebral
Último revisado: 29.06.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
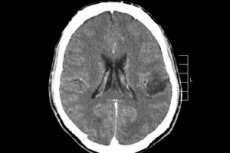
Entre los numerosos procesos tumorales del sistema nervioso central, el glioma cerebral es el más frecuentemente diagnosticado. Este término es general y la neoplasia combina focos difusos de oligodendroglio y astrocitoma, entre ellos astrocitoma, astroblastoma, etc. Este tumor puede presentar diferentes grados de malignidad y se forma a partir de estructuras gliales (células que rodean las neuronas). La principal zona de localización de los gliomas son los hemisferios cerebrales, las paredes de los ventrículos cerebrales y el quiasma (la zona de intersección parcial de las fibras del nervio óptico). Externamente, el tumor es un elemento nodular de color rosado o rojizo, de configuración redondeada o fusiforme, con límites indefinidos. [ 1 ]
Epidemiología
En aproximadamente el 5% de los casos, los gliomas se asocian a patologías hereditarias, en particular, neurofibromatosis y otros síndromes con herencia dominante. Los expertos señalan que la gran mayoría de los gliomas cerebrales se desarrollan esporádicamente, es decir, sin una causa clara.
En general, las neoplasias primarias del sistema nervioso central representan aproximadamente el 2% de todos los tumores, o poco más de 21 casos por cada cien mil habitantes. Entre ellas, los gliomas se presentan en el 35-36% de los casos, y más del 15% son glioblastomas.
Según algunos datos, el glioma afecta con más frecuencia a los hombres que a las mujeres; el tumor es especialmente común entre personas mayores de 50 años.
La incidencia mundial de gliomas en personas mayores ha aumentado significativamente en las últimas décadas. Las causas de este fenómeno aún no se han determinado.
Según la definición de la Organización Mundial de la Salud, se han identificado tres variantes principales de tumores gliales con características histológicas diferentes: oligodendrogliomas, astrocitomas y oligoastrocitomas combinados. La incidencia de cada subtipo de patología de baja malignidad no se ha determinado con precisión. Algunos estudios indican un aumento del 5% al 30% en la incidencia de oligodendrogliomas y una disminución en la de astrocitomas.
Los tumores gliales son capaces de infiltrarse en el tejido cerebral y la gran mayoría de los focos de bajo grado se vuelven malignos en pocos años. [ 2 ]
Causas gliomas cerebrales
El glioma cerebral es un grupo de procesos tumorales cuya característica común es su formación a partir de estructuras gliales del SNC ubicadas en el tejido cerebral. Estos tumores se dividen en dos variantes histopatológicas: gliomas de malignidad alta y de malignidad baja.
La fuente de formación del crecimiento son las células de la neuroglia (astrocitos, oligodendrocitos), que proporcionan la base estructural y la viabilidad de las neuronas cerebrales.
Los procesos tumorales gliales difieren considerablemente en cuanto a estructura, cambios mutacionales en genes, agresividad, características clínicas, características diagnósticas, respuesta al tratamiento y pronóstico de los pacientes. Las neoplasias embrionarias y ependimarias del sistema nervioso central, en particular los meduloblastomas y ependimomas, difieren en su estructura histológica, pero son similares en cuanto a su tratamiento.
Los elementos gliales se clasificaron por primera vez como una categoría estructural separada del sistema nervioso a finales del siglo XIX.
El tejido neuroglial está compuesto por células con funciones auxiliares: tróficas, de soporte, protectoras y secretoras. Las neuronas y los gliocitos coexisten, forman el sistema nervioso y son de gran importancia en los procesos generales de la actividad vital del organismo.
Los gliocitos se clasifican aproximadamente en varias formas principales: astrocitos, oligodendrocitos, células ependimarias y microglía.
Hasta la fecha, los científicos no pueden responder a la pregunta sobre las causas fiables de la formación de tumores neurogliales. Presumiblemente, los efectos radiactivos, las enfermedades infecciosas y las intoxicaciones (especialmente químicas y ocupacionales) contribuyen negativamente. El factor hereditario también es importante.
Los gliomas cerebrales surgen de neurogliocitos anormales con un defecto genético que provoca un crecimiento y una funcionalidad anormales; estas estructuras se denominan "inmaduras". Las células incompletas suelen localizarse en una zona donde se forma el tumor.
En pocas palabras, la formación glial es el resultado del crecimiento caótico y esporádico de células neurogliales modificadas. El proceso puede desarrollarse a partir de ependimocitos, oligodendrocitos y astrocitos (astrocitomas, incluyendo el de células gigantes y el anaplásico). [ 3 ]
Factores de riesgo
A pesar de que los expertos no pueden caracterizar con precisión las causas de la formación de oncopatologías gliales, en algunos casos su aparición se puede prevenir eliminando los principales factores de riesgo:
- La exposición a la radiación ionizante tiene actividad cancerígena y puede provocar el desarrollo de leucemia y la formación de procesos cancerosos de estructura densa, incluso en personas jóvenes. Los procedimientos médicos radiológicos frecuentes e irrazonables, así como la radiación ultravioleta (incluido el solárium), también tienen efectos cancerígenos potenciales y pueden provocar la aparición de tumores en diversos órganos, incluido el cerebro.
- Los efectos adversos ocupacionales, como las intoxicaciones, suelen tener una relación causal con el desarrollo de tumores cancerosos. La producción de caucho y vidrio, pesticidas y combustibles, metales y textiles, pinturas y reactivos de laboratorio se considera particularmente peligrosa. Están en riesgo los trabajadores de las industrias aeroespacial, del carbón y metalúrgica, las plantas de fabricación de productos químicos y derivados, los materiales de construcción y electrodos, los combustibles y lubricantes, los plásticos y los monómeros.
- La contaminación del aire, el agua y el suelo es responsable de hasta el 4% de todas las patologías cancerígenas en el mundo. Los carcinógenos, presentes en grandes cantidades en el ambiente, entran al organismo a través del aire inhalado, el agua potable y los alimentos. Vivir en zonas ecológicamente inseguras, cerca de grandes instalaciones industriales o intercambiadores de transporte concurridos, se considera especialmente peligroso.
- Las patologías infecciosas, en particular las infecciones virales, también pueden propiciar el desarrollo de tumores. Es importante tener esto en cuenta y vacunarse con antelación, así como prevenir enfermedades infecciosas y parasitarias.
- La intoxicación por tabaco y alcohol se consideran factores de riesgo para muchas variedades de cáncer, no sólo los gliomas cerebrales.
- La actividad física insuficiente, el sobrepeso, la nutrición inadecuada, los trastornos metabólicos, los traumatismos craneoencefálicos, las patologías vasculares son factores de estrés adicionales que pueden provocar la aparición de trastornos intracelulares.
- La edad avanzada es el período más común para el desarrollo de neoplasias en el organismo, por lo que los mayores de 55 años deben cuidar especialmente su propia salud.
Sin embargo, el principal y más significativo factor de riesgo para el desarrollo de glioma sigue siendo la predisposición hereditaria.
Patogenesia
Hasta la fecha, los expertos tienen diversas suposiciones sobre el desarrollo de los gliomas cerebrales. Cada teoría tiene sus propios fundamentos, pero los científicos aún no han identificado el único mecanismo patogénico correcto y fiable. En la mayoría de los casos, se trata de los siguientes factores en el desarrollo de neoplasias:
Fallo de la embriogénesis, que consiste en la interrupción de la formación de órganos y la formación de estructuras celulares “erróneas”;
- Exposición a rayos ionizantes, potenciales carcinógenos en forma de agentes químicos, aditivos alimentarios, etc.;
- Traumatismo craneoencefálico;
- Trastornos genéticos que se transmiten de generación en generación (glioma "familiar");
- Disfunción inmune, neuroinfecciones.
La mayoría de los gliomas presentan un crecimiento difuso, con penetración en el tejido cerebral normal circundante. Dependiendo del grado de malignidad, el tumor puede desarrollarse durante varios años sin ninguna manifestación. En caso de evolución agresiva, la sintomatología aumenta rápidamente a lo largo de varios meses.
Parte de la tumorigénesis se debe a cambios disembriogenéticos.
El tronco encefálico puede verse afectado a diferentes niveles: el glioma difuso del tronco encefálico, a su vez, presenta diferencias tanto anatomomorfológicas como clínicas. Algunas de estas neoplasias, en particular el glioma de la placa de cuadriplejia, pueden ser relativamente benignas, sin signos de progresión. Por otro lado, el glioma pontino se caracteriza por su particular malignidad, agresividad y mal pronóstico.
Las lesiones difusas de las estructuras cerebrales, en las que participan más de tres zonas anatómicas de los grandes hemisferios en el proceso patológico, con posible divergencia periventricular y paso a través del cuerpo cerebral, se denominan gliomatosis. [ 4 ]
¿El glioma cerebral es hereditario?
Un riesgo bien demostrado de formación de gliomas cerebrales es hereditario, es decir, la presencia de tumores intracerebrales similares o de otro tipo en antepasados directos o en la misma generación. La exposición a radiactividad y el contacto regular o prolongado con posibles carcinógenos agravan la situación.
Los gliomas no solo son hereditarios, sino también enfermedades que se acompañan de un mayor crecimiento tumoral independientemente de su localización; en particular, pueden ser la neurofibromatosis tipo 1 y tipo 2, el síndrome de Li-Fraumeni y el síndrome de Hippel-Lindau. Con frecuencia, en las células de glioma se detectan cambios en ciertos genes o cromosomas.
Las principales patologías que se asocian al desarrollo de glioma en humanos se resumen en la tabla:
Patología |
Cromosoma |
Gene |
Variedad de neoplasia |
Síndrome de Li-Fraumeni |
17р13 |
TR53 |
Neoplasias neuroectodérmicas, astrocitoma. |
Neurofibromatosis |
17q11 |
NF1 |
Glioma del nervio óptico, astrocitoma pilocítico, neurofibromatosis |
Síndrome de Turcotte |
3p21, 7p22 |
HMLH1, HPSM2 |
Astrocitoma |
Esclerosis tuberosa (síndrome de Burneville). |
9q34, 16p13 |
TSC1, TSC2 |
Astrocitoma subependimario gigantocelular |
Independientemente de la naturaleza del tumor glial, ya sea un caso esporádico o una patología hereditaria, se trata de un trastorno con la expresión de un gen patológicamente alterado. Salvo en el caso de las neoplasias formadas como resultado de efectos de aprendizaje, en otras situaciones las causas de las alteraciones genéticas siguen siendo inciertas.
Síntomas gliomas cerebrales
Las características de la sintomatología focal dependen directamente del área de localización del glioma cerebral y se convierten en una consecuencia de todo tipo de trastornos endocrinos, compresión del tejido nervioso o procesos destructivos locales.
Si la neoplasia se localiza en la zona parietal, la persona se ve afectada por manifestaciones como convulsiones, trastornos sensoriales y pérdida de audición.
Cuando el glioma se localiza en la zona del hemisferio dominante, se detectan trastornos del habla, agrafia, agnosia.
Las neoplasias del lóbulo temporal suelen ir acompañadas de convulsiones, afasia, deterioro del sentido del olfato y de la función visual y disnea.
Cuando aumenta la presión intracraneal, se desarrolla un cuadro correspondiente con restricción de los campos visuales, parálisis de los músculos oculares y hemiplejía.
Debido a la especificidad del proceso tumoral, el glioma cerebral siempre se acompaña de síntomas neurológicos en mayor o menor medida. Al principio, se presenta una notable debilidad general, el paciente necesita dormir constantemente, su capacidad para trabajar se ve afectada y su capacidad de pensamiento se ve ralentizada. Es en esta etapa cuando existe un alto riesgo de realizar un diagnóstico erróneo y, en consecuencia, de prescribir un tratamiento erróneo. Entre otras manifestaciones inespecíficas:
- Trastornos vestibulares, que incluyen marcha inestable, pérdida del equilibrio (p. ej., al andar en bicicleta o subir escaleras), entumecimiento en las extremidades, etc.
- Deterioro progresivo de la visión, duplicación de la imagen visual;
- Deterioro de la función auditiva;
- Habla arrastrada;
- Náuseas y vómitos en forma de ataques independientes de la comida o bebida;
- Debilitamiento de los músculos mímicos y otros músculos faciales;
- Molestias al tragar;
- Dolores de cabeza regulares (a menudo en las horas de la mañana).
El cuadro clínico se extiende y empeora gradualmente: en algunos pacientes, ocurre lentamente; en otros, de forma abrupta, literalmente "ante sus ojos", en pocas semanas. En este último caso, se trata de un glioma cerebral agresivo y de rápida evolución.
Primeros signos
El glioma cerebral en las primeras etapas de desarrollo no presenta una sintomatología pronunciada. Las primeras manifestaciones suelen confundirse con signos de otras patologías menos graves.
En general, el cuadro clínico del glioma es diverso y está determinado por la ubicación y el tamaño del foco patológico. A medida que la neoplasia crece, se desarrollan y aumentan los síntomas cerebrales generales:
- Dolor de cabeza persistente y regular que no responde a los medicamentos estándar (antiinflamatorios no esteroides);
- Náuseas intermitentes, a veces hasta el punto de vomitar;
- Una sensación incómoda y pesada en el área del globo ocular;
- Convulsiones.
Las manifestaciones cerebrales son especialmente intensas cuando el tumor crece hacia los ventrículos o el sistema cefalorraquídeo. El drenaje del líquido cefalorraquídeo se ve afectado, la presión intracraneal aumenta y se desarrolla hidrocefalia. El proceso afecta una parte específica del cerebro, lo que influye en el desarrollo de la clínica correspondiente:
- Hay problemas con la función visual;
- Discapacidad del habla;
- Se producen trastornos vestibulares (mareos, alteración de la coordinación de movimientos);
- Parálisis, paresia de brazos y piernas;
- La memoria y la concentración se ven afectadas;
- Los procesos de pensamiento se ven afectados;
- Están surgiendo trastornos del comportamiento.
En la etapa inicial, los síntomas son prácticamente inexistentes o tan leves que pasan desapercibidos. Por ello, los expertos recomiendan encarecidamente realizar exámenes y chequeos preventivos periódicos. Al fin y al cabo, cuanto antes se detecte el proceso tumoral, mayores serán las posibilidades de curación y supervivencia. [ 5 ]
Glioma cerebral en un niño
Entre los numerosos tumores cerebrales que se detectan en la infancia, el porcentaje de gliomas oscila entre el 15 y el 25 %. Los niños pueden desarrollar la enfermedad al comienzo de la adolescencia y a principios de los veinte años, aunque es muy poco frecuente que los bebés menores de 3 años la padezcan.
La patología se inicia en el contexto de una mutación de las células gliales. Hasta la fecha, no se ha determinado la causa de esta mutación.
Lo único que se ha aprendido con certeza es que ciertas enfermedades hereditarias asociadas con un mayor riesgo de crecimiento de tumores también aumentan la probabilidad de desarrollar glioma cerebral.
Además, los científicos han descubierto que las células gliales pueden presentar divergencia en genes o cromosomas individuales. Debido a este trastorno, se activa un mecanismo de mutación no hereditario. Es posible que esto ocurra en una de las primeras etapas del desarrollo.
Es un hecho comprobado que la presencia de leucemia aguda o retinoblastoma en la historia del niño, o irradiación cerebral por cualquier otro motivo, aumenta significativamente los riesgos de formación de gliomas (después de un cierto período de tiempo).
La sintomatología en la infancia depende del grado de malignidad y de la localización del foco patológico. Se distingue entre síntomas específicos e inespecíficos:
- Los síntomas inespecíficos no están ligados a la zona donde se ubica el glioma. Las manifestaciones comunes pueden incluir dolor de cabeza, mareos, falta de apetito, vómitos sin relación con la ingesta de alimentos, pérdida de peso (por razones desconocidas), sensación constante de fatiga, disminución del rendimiento académico, dificultad para concentrarse y trastornos del comportamiento. Estos signos se deben a la compresión de las estructuras intracraneales, que puede explicarse por la presión directa de la masa en crecimiento, y a un trastorno en la circulación del líquido cefalorraquídeo. Existe riesgo de hidrocele cerebral.
- La sintomatología específica depende de la localización inmediata del foco patológico glial. Por ejemplo, un tumor cerebeloso suele acompañarse de alteración de la marcha y el equilibrio en niños. La lesión del cerebro grande se manifiesta con convulsiones y crecimiento tumoral en la médula espinal (parálisis muscular). Puede ocurrir que la visión del bebé se deteriore drásticamente, se altere la consciencia, se altere el sueño o se presente algún otro problema de desarrollo.
Por regla general, en la infancia, el glioma maligno se manifiesta tras varias semanas o meses de su desarrollo: a menudo se caracteriza por un crecimiento rápido y descontrolado de la neoplasia.
Los niños con tumores gliales malignos son tratados por médicos en centros clínicos pediátricos especializados en oncología pediátrica. Generalmente, se utilizan tratamientos quirúrgicos, radioterapia y quimioterapia.
El paso más importante del tratamiento es la neurocirugía. Cuanto más radical sea, mayores serán las probabilidades de curación del niño. Sin embargo, la intervención quirúrgica no siempre es posible: en particular, pueden surgir problemas con la extirpación de gliomas del tronco encefálico, así como con la radioterapia en niños menores de 3 años.
Los gliomas del encéfalo central (intermedio y mesencéfalo) son difíciles de extirpar por completo, ya que existe el riesgo de dañar el tejido sano. Si la resección completa del tumor es imposible, se prescribe al paciente tratamiento paliativo.
Los niños con gliomas malignos reciben tratamiento según protocolos estandarizados, determinados mediante ensayos clínicos rigurosamente controlados. Los protocolos más comunes son los siguientes:
- HIT HGG 2007: incluye el tratamiento de niños de 3 a 17 años.
- HIT SKK: adecuado para bebés (hasta tres años de edad) y no implica tratamientos de radiación.
Las estadísticas de supervivencia pediátrica para los gliomas no suelen ser muy optimistas. Sin embargo, en ningún caso es posible predecir con antelación la eficacia del tratamiento para un niño en particular. Es importante seguir cuidadosamente todas las indicaciones del médico, lo que aumenta significativamente las probabilidades de recuperación.
Formas
Los gliomas pueden ser de baja y alta malignidad, con un crecimiento intenso y propensión a la metástasis. Es importante comprender que una baja malignidad no es sinónimo de seguridad tumoral. Cualquier neoplasia cerebral crea volumen adicional y comprime las estructuras cerebrales, lo que provoca su desplazamiento y un aumento de la presión intracraneal. Como resultado, el paciente puede fallecer.
Existen dos tipos principales de astrocitomas malignos: los glioblastomas y los astrocitomas anaplásicos, que se subdividen según sus cambios moleculares. Los tumores malignos secundarios, derivados de astrocitomas y con bajo grado de malignidad, se presentan con mayor frecuencia en pacientes jóvenes. Los tumores gliales inicialmente malignos son más frecuentes en pacientes de edad avanzada.
Dependiendo de la ubicación estructural, los gliomas se presentan en:
- Supratentorial (con localización por encima del cerebelo en la zona de los ventrículos laterales, hemisferios grandes);
- Subtentorial (con localización debajo del cerebelo en la fosa craneal posterior).
Según las características histológicas, se distinguen los siguientes tipos de gliomas:
- El glioma astrocítico es el más común. A su vez, se subdivide en nodular y difuso (este último se caracteriza por un crecimiento rápido y un patrón de ictus).
- Oligodendroglioma: se presenta en el 5% de los pacientes. Presenta petrificaciones (áreas de calcificación), con mayor frecuencia en el lóbulo frontal.
- Glioma ependimario: crece a partir de las estructuras que recubren las paredes del canal central de la médula espinal y los ventrículos. A menudo crece hacia el espesor de la sustancia cerebral, así como hacia el lumen cerebral.
También son posibles focos patológicos mixtos como subependimoma, oligoastrocitoma, etc.
Todos los gliomas se clasifican en los siguientes estadios:
- Neoplasias relativamente benignas de crecimiento lento sin síntomas clínicos evidentes.
- Gliomas “limítrofes” de crecimiento lento que se transforman gradualmente en estadio III y superiores.
- Glioma maligno.
- Glioma maligno de intenso crecimiento agresivo y diseminación, con mal pronóstico.
Cuanto menor sea el estadio de malignidad, menor será la probabilidad de metástasis y recurrencia de la neoplasia extirpada, y mayores las posibilidades de curación del paciente. El mayor peligro lo representa el glioblastoma multiforme, un proceso poco diferenciado con un crecimiento y desarrollo intensos. [ 6 ]
Variantes posibles y más comunes del neuroglioma:
- El glioma con lesiones del tronco encefálico y protuberancia se localiza en la zona donde el cerebro se conecta con la médula espinal. Allí se localizan importantes neurocentros responsables de la función respiratoria, cardíaca y motora. Si esta zona se daña, se altera el funcionamiento del aparato vestibular y del habla. Suele detectarse en la infancia.
- El glioma visual afecta a las células neurogliales que rodean el nervio óptico. Esta patología causa discapacidad visual y exoftalmos. Se presenta con mayor frecuencia en niños.
- El neuroglioma maligno bajo se caracteriza por un crecimiento lento y se localiza con mayor frecuencia en los hemisferios grandes y el cerebelo. Se presenta con mayor frecuencia en jóvenes (adolescentes y adultos jóvenes alrededor de los 20 años).
- El glioma del cuerpo calloso es más característico de individuos entre 40 y 60 años de edad y está representado más comúnmente por el glioblastoma.
- El glioma del quiasma se localiza en la zona de la unión óptica, por lo que se acompaña de miopía, pérdida del campo visual, hidrocefalia oclusiva y trastornos neuroendocrinos. Puede presentarse a cualquier edad, pero afecta con mayor frecuencia a pacientes con neurofibromatosis tipo I.
Complicaciones y consecuencias
Gliomas de baja malignidad (grados I-II, altamente malignos; p. ej., astrocitoma, oligoastrocitoma, oligodendroglioma, xantoastrocitoma pleomórfico, etc.) y de alta malignidad (grados III-IV: glioblastoma, oligodendroglioma anaplásico, oligoastrocitoma y astrocitoma). Los gliomas de grado IV son particularmente malignos.
El glioma del tronco encefálico tiene un pronóstico muy desfavorable precisamente porque la neoplasia afecta dicha región cerebral, donde se concentran las conexiones nerviosas más importantes entre el cerebro y las extremidades. Incluso un tumor relativamente pequeño en esta zona es suficiente para que el estado del paciente se deteriore rápidamente y provoque parálisis.
Las consecuencias no son menos desfavorables cuando se ven afectadas otras regiones cerebrales. A menudo se trata de un tumor en la corteza cerebral, que impide una larga esperanza de vida del paciente, a pesar del tratamiento. Con frecuencia, solo es posible posponer la muerte.
Según las estadísticas médicas, la tasa de supervivencia a cinco años suele ser de tan solo el 10-20 %. Si bien estas cifras dependen en gran medida tanto del grado de malignidad como de la localización exacta y el volumen de la intervención quirúrgica realizada. Tras la extirpación completa del foco patológico, la tasa de supervivencia aumenta significativamente (en ocasiones, hasta el 50 %). La falta de tratamiento o su imposibilidad (por una u otra razón) puede conducir a la muerte del paciente.
La mayoría de los tumores gliales malignos bajos pueden infiltrarse en el tejido cerebral y malignizarse a lo largo de varios años.
Los expertos consideran que el riesgo de recurrencia del glioma es muy probable. Sin embargo, no se debe descuidar el tratamiento: es importante garantizar una buena calidad de vida durante el mayor tiempo posible.
Los gliomas recurrentes siempre tienen peor pronóstico que los tumores primarios. Sin embargo, los protocolos de tratamiento modernos, basados en estudios de optimización terapéutica, suelen lograr resultados suficientemente buenos en pacientes, incluso con neoplasias altamente malignas.
Posibles resultados después de la quimioterapia:
- Emaciación, emaciación, trastornos digestivos, enfermedades bucales;
- Aumento de la excitabilidad del sistema nervioso central, astenia;
- Deterioro de la función auditiva, tinnitus y zumbidos en los oídos;
- Convulsiones, trastornos depresivos;
- Crisis hipertensiva, alteración del patrón sanguíneo;
- Insuficiencia renal;
- Procesos alérgicos, caída del cabello, aparición de manchas pigmentarias en el cuerpo.
Después de la quimioterapia, los pacientes notan un debilitamiento pronunciado del sistema inmunológico, lo que puede provocar el desarrollo de diversas patologías infecciosas.
Diagnostico gliomas cerebrales
Un glioma cerebral se puede sospechar por los siguientes signos:
- El paciente presenta convulsiones localizadas o generalizadas, características de la localización cortical de la neoplasia y su lento desarrollo. Se observan epiconvulsiones en el 80 % de los pacientes con tumores gliales de bajo grado y en el 30 % de los pacientes con gliomas de alto grado.
- El aumento de la presión intracraneal es particularmente característico de las masas ubicadas en los lóbulos frontal y parietal derechos. Asociado con la presión intracraneal alta, el trastorno de la circulación sanguínea y del líquido cefalorraquídeo conlleva la aparición de dolor de cabeza constante y creciente, náuseas y vómitos, alteraciones visuales y somnolencia. Se presenta edema del nervio óptico y parálisis del nervio desviador. Un aumento de la presión intracraneal a valores críticos puede provocar coma y la muerte. Otra causa de PIO alta es la hidrocefalia.
- El paciente presenta un cuadro focal creciente. En las formaciones supratentoriales, se alteran las esferas motora y sensorial, y progresan la hemiopía, la afasia y los trastornos cognitivos.
Si el médico sospecha la presencia de una neoplasia cerebral, lo óptimo es realizar una resonancia magnética con o sin contraste (gadolinio) para determinar su ubicación, tamaño y otras características. Si no es posible obtener una resonancia magnética, se realiza una tomografía computarizada y se utiliza la espectroscopia por resonancia magnética como método de diferenciación. A pesar del valor informativo de estos métodos diagnósticos, el diagnóstico definitivo solo se realiza tras la confirmación histológica durante la resección del foco tumoral.
Dados los criterios anteriores, se recomienda iniciar el diagnóstico con una historia clínica completa y una evaluación del estado somatoneurológico y funcional. El estado neurológico se evalúa junto con la determinación de probables trastornos intelectuales y mnésicos.
Pruebas de laboratorio recomendadas:
- Un análisis de sangre clínico general completo;
- Un panel de química sanguínea completo;
- Análisis de orina;
- Estudio de la coagulación sanguínea;
- Análisis de marcadores oncológicos (AFP, beta-hCG, LDH – relevante si se sospecha lesión de la zona pineal).
Para aclarar los puntos pronósticos en pacientes con glioblastoma y astrocitoma anaplásico, se evalúa la mutación del gen IDH1|2-1 y la metilación del gen MGMT. En pacientes con oligodendroglioma y oligoastrocitoma, se determina la codulación de 1p|19q.
El diagnóstico instrumental se realiza, en primer lugar, mediante la resonancia magnética obligatoria del cerebro (en ocasiones, y de la médula espinal). La resonancia magnética se realiza en tres proyecciones utilizando los modos estándar T1-2, FLAIR y T1 con contraste.
Cuando está indicado se realizan ecografía de la red vascular, resonancia magnética funcional de las secciones motora y del habla, así como angiografía, espectroscopia, tractografía por RM y perfusión.
Las investigaciones adicionales pueden incluir:
- Electroencefalografía del cerebro;
- Consultas con neurocirujano, oncólogo, radiólogo, oftalmólogo, radiólogo.
Diagnóstico diferencial
El diagnóstico diferencial se realiza necesariamente con patologías no tumorales, en particular, con hemorragias causadas por malformaciones arteriovenosas o arteriales, así como con procesos desmielinizantes pseudotumorales, enfermedades inflamatorias (toxoplasmosis, absceso cerebral, etc.).
Además, diferenciar el foco tumoral primario y las metástasis del sistema nervioso central.
Gracias a las modernas capacidades de la resonancia magnética, es posible realizar pruebas diagnósticas con la precisión suficiente para determinar el origen del foco primario en el SNC. La resonancia magnética cerebral se realiza con o sin contraste, en modo T1, T2 FLAIR (en tres proyecciones) o cortes finos en proyección axial (modo SPGR). Estos métodos diagnósticos permiten determinar con precisión la ubicación, el tamaño, las características estructurales de la neoplasia, su relación con la red vascular y las áreas cerebrales cercanas.
Además, como parte del diagnóstico diferencial, se pueden realizar TC (con o sin contraste), angiografía por TC (angiografía por RM), tractografía por RM y perfusión por RM o TC. Cuando está indicado, se utiliza TC/PET cerebral con metionina, colina, tirosina y otros aminoácidos.
Tratamiento gliomas cerebrales
El tratamiento específico consiste en medidas quirúrgicas, quimioterapéuticas y radioterapia. Es fundamental, de ser posible, realizar una resección completa del foco tumoral, lo que permite un alivio rápido de los síntomas y la confirmación histológica del diagnóstico.
La irradiación tiene un efecto positivo en el aumento de la esperanza de vida de los pacientes. Se administra una dosis total de 58 a 60 Gy, dividida en dosis individuales de 1,8 a 2 Gy. El tumor se irradia localmente, capturando además hasta 3 cm a su alrededor. La radioterapia es más adecuada que la braquiterapia. En algunos casos, se recomiendan métodos radioquirúrgicos, que consisten en la irradiación con un bisturí de rayos gamma o un acelerador lineal, así como la boroterapia con captura de neutrones.
La necesidad de quimioterapia adyuvante es controvertida. En algunos casos, las preparaciones de nitrosourea permitieron aumentar la esperanza de vida de los pacientes hasta un año y medio, pero algunos resultados fueron negativos. Actualmente, se utilizan activamente agentes citotóxicos, terapia neoadyuvante (antes de la radioterapia), fármacos combinados, quimioterapia intraarterial o quimioterapia de alta dosis con trasplante de células madre.
En general, para un tratamiento exitoso de los gliomas es muy importante un enfoque integral, cuya extensión depende de la ubicación y el grado de malignidad de la masa, su tamaño y la salud general del paciente.
En el caso del glioma del tronco encefálico, la intervención quirúrgica se utiliza con poca frecuencia. La principal contraindicación para la cirugía es la ubicación del foco, es decir, su proximidad a órganos vitales. En algunos casos, es posible extirpar el glioma del tronco mediante métodos microquirúrgicos, con quimioterapia preoperatoria y posoperatoria. Esta intervención es muy compleja y requiere la cualificación especial de un neurocirujano.
La radiocirugía, y en particular la cirugía estereotáctica con exposición a altas dosis ionizantes, es bastante eficaz. El uso de esta técnica en las primeras etapas del desarrollo de la neoplasia a veces permite lograr una remisión prolongada o incluso la curación completa del paciente.
La radioterapia suele combinarse con quimioterapia, lo que mejora la eficacia de las intervenciones y reduce la carga de radiación. En los gliomas, no todos los agentes quimiopreventivos tienen éxito terapéutico, por lo que se prescriben individualmente y las prescripciones se ajustan si es necesario.
Para reducir el dolor y disminuir la presión intracraneal, independientemente del tratamiento principal, se prescribe una terapia sintomática, en particular, corticosteroides, analgésicos y sedantes.
Medicamentos
Los corticosteroides afectan la inflamación y reducen la gravedad de los síntomas neurológicos durante varios días. Sin embargo, debido a los múltiples efectos secundarios y a la mayor probabilidad de interacciones adversas con los fármacos quimioterapéuticos, se utilizan dosis mínimamente efectivas de esteroides y se suspenden lo antes posible (p. ej., después de una cirugía).
Los anticonvulsivos se utilizan sistemáticamente como medida de prevención secundaria en pacientes que ya han sufrido convulsiones epilépticas. Estos medicamentos pueden causar síntomas adversos graves e interactuar con los fármacos quimioterapéuticos.
Los anticoagulantes son especialmente relevantes en la fase postoperatoria, ya que los riesgos de formación de tromboflebitis en el glioma son bastante altos (hasta un 25%).
Se espera un buen efecto al tomar antidepresivos-ansiolíticos. El uso de metilfenidato, 10-30 mg/día en dos dosis, suele optimizar las capacidades cognitivas, mejorar la calidad de vida y mantener la capacidad laboral.
La insuficiencia neurológica y los signos de edema cerebral (dolor en la cabeza, alteraciones de la conciencia) se eliminan con medicamentos corticosteroides, en particular prednisolona o dexametasona. |
El esquema y la dosis de corticosteroides se seleccionan individualmente, aplicándose la dosis mínima efectiva. Al finalizar el tratamiento, los fármacos se retiran gradualmente. |
Los corticosteroides se toman junto con medicamentos gastroprotectores: bloqueadores de la bomba de protones o bloqueadores de la histamina H2. |
Los diuréticos (furosemida, manitol) se prescriben para la hinchazón severa y el desplazamiento de las estructuras cerebrales, como complemento a los medicamentos corticosteroides. |
En caso de convulsiones (incluida la anamnesis) o síntomas epileptiformes en el electroencefalograma, se prescribe adicionalmente tratamiento anticonvulsivo. Los anticonvulsivos no se prescriben con fines profilácticos. |
Se recomienda a los pacientes con indicación de quimioterapia tomar anticonvulsivos que no afecten la función de las enzimas hepáticas. Fármacos de elección: lamotrigina, ácido valproico, levetiracetam. No deben utilizarse: carbamazepina, fenobarbital. |
El dolor de cabeza en los gliomas cerebrales se controla con tratamiento con corticosteroides. |
En algunos casos de dolor de cabeza se pueden utilizar antiinflamatorios no esteroides o tramadol. |
Si el paciente está tomando medicamentos antiinflamatorios no esteroides, se suspenden unos días antes de la cirugía para minimizar la posibilidad de sangrado durante la cirugía. |
En casos de dolor seleccionados, se pueden recomendar analgésicos narcóticos, como fentanilo o trimeperidina. |
Para prevenir la embolia pulmonar a partir del tercer día postoperatorio se prescribe la administración de heparinas de bajo peso molecular, en particular Enoxaparina sódica o Nadroparina cálcica. |
Si el paciente está en tratamiento anticoagulante o antiagregante sistémico, se pasa a heparinas de bajo peso molecular a más tardar una semana antes de la intervención quirúrgica, con posterior retirada de las mismas un día antes de la cirugía y reanudación 24-48 horas después de la misma. |
Si un paciente con glioma presenta trombosis venosa en las extremidades inferiores, se le administrarán anticoagulantes directos. No se descarta la posibilidad de colocar un filtro CAVA. |
Quimioterapia para gliomas malignos del cerebro
Los regímenes básicos de quimioterapia antitumoral para los gliomas se consideran:
- Lomustina 100 mg/m² el primer día, Vincristina 1,5 mg/m² los días uno y ocho, Procarbazina 70 mg/m² desde el día ocho al vigésimo primero, tratamientos cada seis semanas.
- Lomustina 110 mg/m² cada seis semanas.
- Temozolomida 5/23 150 a 200 mg/m² desde el día uno hasta el día cinco, cada 28 días.
- Temozolomida como parte del tratamiento de quimiorradiación, 75 mg/m² cada día que se administra radiación.
- Temozolomida con cisplatino o carboplatino (80 mg/m²) y temozolomida 150-200 mg/m² los días 1 a 5 cada 4 semanas.
- Temozolomida 7/7 a 100 mg/m² los días 1-8 y 15-22 del tratamiento, con repetición cada cuatro semanas.
- Bevacizumab 5 a 10 mg/kg los días uno y quince, e irinotecán 200 mg/m² los días uno y quince, repetido cada cuatro semanas.
- Bevacizumab 5 a 10 mg/kg los días uno, quince y veintinueve, y Lomustina 90 mg/m² el día uno cada seis semanas.
- Bevacizumab 5 a 10 mg/kg los días uno y quince, Lomustina 40 mg los días uno, ocho, quince y veintidós, repetido cada seis semanas.
- Bevacizumab 5 a 10 mg/kg los días uno y quince, repetido cada cuatro semanas.
En muchos casos, los fármacos citostáticos inhiben con éxito el crecimiento de células tumorales, pero no muestran selectividad hacia los tejidos y órganos sanos. Por lo tanto, los expertos han identificado una serie de contraindicaciones en las que la quimioterapia para el glioma es imposible:
- Sensibilidad individual excesiva a los agentes quimiopreventivos;
- Descompensación de la función cardíaca, renal, hepática;
- Hematopoyesis deprimida en la médula ósea;
- Problemas de la función suprarrenal.
La quimioterapia se administra con extrema precaución:
- Pacientes con alteraciones significativas del ritmo cardíaco;
- Con diabetes;
- Para infecciones virales agudas;
- A pacientes de edad avanzada;
- Pacientes que padecen alcoholismo crónico (intoxicación alcohólica crónica).
El efecto secundario más grave de los fármacos quimiopreventivos es su toxicidad: los citostáticos interfieren selectivamente con la funcionalidad de las células sanguíneas y modifican su composición. Como consecuencia, la masa de plaquetas y eritrocitos disminuye y se desarrolla anemia.
Antes de prescribir quimioterapia a un paciente, el médico siempre considera el grado de toxicidad de los fármacos y las posibles complicaciones posteriores. Los tratamientos de quimioterapia siempre son supervisados cuidadosamente por especialistas y se realizan análisis de sangre regulares.
Posibles consecuencias de la terapia citostática:
- Delgadez, emaciación;
- Dificultad para tragar alimentos, mucosas secas, periodontitis, dispepsia;
- Inestabilidad del sistema nervioso central, trastornos maníaco-depresivos, síndrome convulsivo, astenia;
- Deterioro de la función auditiva;
- Aumento de la presión arterial hasta el desarrollo de crisis hipertensiva;
- Disminución de plaquetas, glóbulos rojos, glóbulos blancos, hemorragias múltiples, sangrado interno y externo;
- Insuficiencia renal;
- Procesos alérgicos;
- Pérdida de cabello, aparición de zonas de mayor pigmentación.
Después de los tratamientos de quimioterapia, los pacientes tienen un mayor riesgo de desarrollar enfermedades infecciosas y es frecuente que tengan dolores musculares y articulares.
Para reducir el riesgo de efectos adversos posquimioterapéuticos, se prescriben medidas de rehabilitación adicionales, cuyo objetivo es restablecer el hemograma normal, estabilizar la actividad cardiovascular y normalizar el estado neurológico. Se proporciona apoyo psicológico adecuado.
Tratamiento quirúrgico
La cirugía se realiza para eliminar el máximo foco tumoral, lo que a su vez debería reducir la presión intracraneal, disminuir la insuficiencia neurológica y proporcionar el biomaterial necesario para la investigación.
- La cirugía se realiza en un departamento o clínica neuroquirúrgica especializada cuyos especialistas tienen experiencia en intervenciones neurooncológicas.
- El cirujano realiza el acceso mediante trepanación ósea plástica en la zona donde se sospecha la localización del glioma.
- Si la neoplasia está localizada anatómicamente cerca de áreas o vías motoras, o en los núcleos o a lo largo de los nervios craneales, se utiliza monitorización neurofisiológica intraoperatoria.
- Sistemas de neuronavegación, la navegación fluorescente intraoperatoria con ácido 5-aminolevulénico es deseable para maximizar la eliminación de la neoplasia.
- Tras la intervención se realiza una TC o RMN de control (con o sin inyección de contraste) el día 1-2.
Si la resección quirúrgica del glioma es imposible o inicialmente se reconoce como inoportuna, o si se sospecha un linfoma del sistema nervioso central, se realiza una biopsia (abierta, estereotáctica, con monitorización de navegación, etc.). |
Los pacientes con gliomatosis cerebral se verifican mediante biopsia estereotáctica, ya que las tácticas terapéuticas dependen en gran medida del cuadro histológico. |
En determinadas situaciones (en pacientes de edad avanzada, en caso de trastornos neurológicos graves, en caso de localización del glioma en el tronco y otras partes vitales), el tratamiento se planifica en función de los síntomas y la información de imágenes después de una consulta médica general. |
Se recomienda a los pacientes con astrocitoma piloide, así como formas nodulares de neoplasias del tronco encefálico y procesos exofíticos, someterse a una resección o biopsia abierta. |
Los pacientes con glioma pontino difuso y otras neoplasias difusas del tronco reciben tratamiento con radioterapia y fármacos antitumorales. En estos casos, no es necesaria la verificación. |
Los pacientes con glioma de placa tetrapléjico se someten a resonancia magnética sistemática y seguimiento clínico tras la extirpación del hidrocele cerebral. Si la neoplasia muestra signos de crecimiento, se extirpa con radioterapia adicional. |
Cuando se realiza una resección parcial o una biopsia de un glioma maligno de bajo grado, los pacientes con dos o más factores de riesgo son necesariamente tratados con radiación y/o quimioterapia. |
La resección total es obligatoria para pacientes con astrocitoma de células gigantes subependimario. |
Everolimus se prescribe para el astrocitoma subependimario difuso de células gigantes. |
El astrocitoma piloide debe extirparse con resonancia magnética después de la intervención para aclarar la calidad de la resección radical del tejido tumoral. |
En el glioblastoma, el tratamiento postoperatorio debe combinarse (radiación + quimioterapia) con la administración de temozolomida. |
En el astrocitoma anaplásico, tras la cirugía, se indica radioterapia con tratamiento farmacológico adicional. Se utilizan lomustina y temozolomida. |
Los pacientes con oligodendroglioma anaplásico u oligoastrocitoma reciben radiación y quimioterapia (monoterapia con temozolomida o PCV) después de la cirugía. |
Los pacientes de edad avanzada con glioma maligno extenso se irradian en modo hipofraccionado o se realiza monoterapia con temozolomida. |
En caso de recurrencia del glioma, un consejo de especialistas analiza la posibilidad de una reintervención y las estrategias de tratamiento posteriores. El régimen óptimo para las recurrencias es: reintervención + quimioterapia sistémica + radioterapia repetida + medidas paliativas. Si existen áreas localizadas menores de crecimiento tumoral recurrente, se puede utilizar radiocirugía. |
Los fármacos de elección para el crecimiento recurrente del glioma son temozolomida y bevacizumab. |
La recurrencia de oligodendrogliomas altamente malignos y astrocitomas anaplásicos es una indicación para el tratamiento con temozolomida. |
El xantoastrocitoma pleomórfico se elimina sin quimioterapia adyuvante obligatoria. |
Una de las peculiaridades de los gliomas es la dificultad de su tratamiento y extirpación. El cirujano busca extirpar el tejido de la neoplasia lo más completamente posible para lograr una mejoría de la afección. Muchos pacientes logran mejorar y prolongar su calidad de vida, pero en el caso de los tumores altamente malignos, el pronóstico sigue siendo desfavorable: existe una mayor probabilidad de recrecimiento del foco patológico.
Nutrición para el glioma cerebral
La dieta para pacientes con tumores malignos es un punto importante al que, lamentablemente, muchas personas no prestan mucha atención. Mientras tanto, gracias a cambios en la dieta, es posible ralentizar el desarrollo del glioma y fortalecer el sistema inmunitario debilitado.
Áreas principales del cambio dietético:
- Normalización de los procesos metabólicos, fortalecimiento de la protección inmunológica;
- Desintoxicación del cuerpo;
- Optimización del potencial energético;
- Garantizar el funcionamiento normal de todos los órganos y sistemas del cuerpo durante un período tan difícil para ellos.
Una dieta racional y equilibrada es fundamental tanto para pacientes con neoplasias malignas en etapas tempranas como para pacientes con glioblastoma en etapa avanzada. Una dieta cuidadosamente seleccionada contribuye a mejorar el bienestar general y a la recuperación de los tejidos dañados, lo cual es especialmente importante durante el tratamiento con citostáticos y radioterapia. El equilibrio nutricional y los procesos metabólicos adecuados previenen la formación de focos infecciosos, bloquean las reacciones inflamatorias y previenen el agotamiento corporal.
Se recomiendan los siguientes alimentos y bebidas para el glioma cerebral:
- Frutas y verduras de color rojo, amarillo y naranja (tomates, melocotones, albaricoques, zanahorias, remolachas, frutas cítricas) que contienen carotenoides, que protegen las células sanas de los efectos negativos de la radioterapia;
- Repollo (coliflor, brócoli, coles de Bruselas), rábano, mostaza y otros productos vegetales que contienen indol, sustancia activa que neutraliza factores tóxicos y químicos adversos;
- Verduras verdes (eneldo, perejil, hojas tiernas de diente de león y de ortiga, ruibarbo, rúcula, espinacas), guisantes y espárragos verdes, judías verdes y algas (algas marinas, espirulina, clorella);
- Té verde;
- Ajo, cebolla, piña, que tienen capacidad antitumoral y desintoxicante;
- Salvado, cereales, pan integral, brotes germinados de legumbres, granos y semillas;
- Uvas negras, frambuesas, fresas y fresas, arándanos, moras, granadas, grosellas, grosellas negras, serbas, arándanos, espino amarillo, cerezas y otras bayas que contienen antioxidantes naturales que reducen los efectos negativos de los radicales libres, virus y carcinógenos;
- Productos lácteos bajos en grasa.
No se debe sobrecargar el sistema digestivo ni el cuerpo con alimentos pesados y grasosos. Es recomendable consumir jugos, batidos y bocaditos caseros recién exprimidos. Se deben añadir a las comidas fuentes de ácidos grasos omega-3, como aceite de pescado, aceite de linaza o semillas de lino.
Es mejor evitar por completo el azúcar y los dulces. Pero una cucharada de miel con un vaso de agua no hará daño: los productos apícolas tienen un marcado efecto antiinflamatorio, antioxidante y antitumoral. La única contraindicación para el uso de la miel es la alergia al producto.
De la dieta deben excluirse:
- Carne, manteca, despojos;
- Mantequilla, productos lácteos grasos;
- Carnes ahumadas, embutidos, conservas de carne y pescado;
- Alcohol en cualquier forma;
- Dulces, bollería, tartas y pasteles, caramelos y chocolates;
- Comidas preparadas, comida rápida, snacks;
- Alimentos fritos.
Debes consumir suficientes verduras, hortalizas, frutas y agua potable limpia a diario.
Durante la quimioterapia y durante un tiempo después, debe beber jugos de frutas y verduras caseros, consumir requesón, leche y queso caseros bajos en grasa. Es importante beber mucho líquido, cepillarse los dientes y enjuagarse la boca con frecuencia (unas 4 veces al día).
Comidas óptimas para pacientes con glioma cerebral:
- Guisos de verduras;
- Guarniciones y sopas a base de cereales (preferiblemente trigo sarraceno, avena, arroz, cuscús, bulgur);
- Tartas de queso al vapor, budines, guisos;
- Verduras guisadas y al horno;
- Guisos, sopas de verduras, primeros y segundos platos de legumbres (incluida la soja), patés y suflés;
- Batidos, té verde, compotas y bocados.
Prevención
Si una persona lleva un estilo de vida saludable y no ha tenido casos de cáncer en su familia, tiene todas las posibilidades de no desarrollar un glioma cerebral. No existe una prevención específica para estos tumores, por lo que las principales medidas preventivas son una nutrición adecuada, la actividad física, evitar malos hábitos y evitar riesgos laborales y domésticos.
Los especialistas dan una serie de recomendaciones sencillas, pero efectivas:
- Beba más agua pura, evite los refrescos azucarados, los jugos envasados, las bebidas energéticas y el alcohol.
- Evite riesgos laborales y domésticos: menor contacto con productos químicos, soluciones corrosivas y líquidos.
- Intenta preparar la comida hirviéndola, guisándola u horneándola, pero no friéndola. Da preferencia a los alimentos caseros, saludables y de calidad.
- Una gran proporción de su dieta debe estar compuesta por alimentos vegetales, incluidas las verduras de hoja verde, independientemente de la época del año.
- Otro factor negativo es el sobrepeso, que conviene eliminar. Controlar el peso es fundamental para la salud general del organismo.
- Los aceites vegetales siempre deben preferirse a la mantequilla y la manteca de cerdo.
- Si es posible, conviene preferir productos ecológicos, carne sin hormonas, verduras y frutas sin nitratos ni pesticidas. Es mejor evitar por completo la carne roja.
- No tome multivitamínicos sin receta médica ni en grandes cantidades. No tome ningún medicamento sin receta médica: la automedicación suele ser muy peligrosa.
- Si aparecen síntomas sospechosos, es necesario visitar a un médico, sin esperar la agravación de la situación, el desarrollo de efectos adversos y complicaciones.
- Los dulces y alimentos con un índice glucémico alto son un componente indeseable de la dieta.
- Cuanto antes acuda una persona al médico, mayores serán sus posibilidades de curación (y esto se aplica a casi cualquier enfermedad, incluido el glioma cerebral).
Para prevenir la formación de oncopatología, es necesario dormir y descansar lo suficiente, evitar el consumo excesivo de bebidas alcohólicas, dar preferencia a alimentos naturales de alta calidad y reducir el uso de dispositivos electrónicos (en particular, teléfonos móviles).
Las enfermedades tumorales suelen presentarse en personas mayores. Por lo tanto, es importante cuidar la salud desde una edad temprana y evitar provocar procesos patológicos con un estilo de vida y hábitos poco saludables.
Las causas exactas de la oncología aún no se han esclarecido. Sin embargo, las condiciones laborales y ambientales desfavorables, la exposición a radiaciones ionizantes y electromagnéticas y los cambios hormonales influyen en cierta medida. Evite exponerse al sol de forma prolongada y regular, permita cambios repentinos de temperatura ambiente, sobrecaliente en el baño o la sauna y tome baños o duchas calientes con frecuencia.
Otra pregunta: ¿cómo prevenir la recurrencia de un glioma cerebral tras un tratamiento exitoso? La recurrencia del crecimiento neoplásico es una complicación compleja y, lamentablemente, frecuente, difícil de predecir con antelación. Se puede recomendar a los pacientes que se sometan a exámenes y chequeos preventivos regulares, visiten a un oncólogo y a su médico de cabecera al menos dos veces al año, lleven un estilo de vida saludable, consuman alimentos sanos y naturales, y practiquen actividad física moderada. Otra condición es el amor por la vida, un optimismo sano y una actitud positiva ante el éxito en cualquier circunstancia. Esto también incluye un ambiente familiar y laboral cordial, paciencia y el apoyo incondicional de sus seres queridos.
Pronóstico
El estado del cerebro y las características del glioma en el momento de su detección influyen en la tasa de supervivencia tanto como el tratamiento administrado. Un buen estado de salud general del paciente y su edad mejoran el pronóstico (el pronóstico es más optimista en pacientes jóvenes). Un indicador importante es el cuadro histológico de la neoplasia. Así, los gliomas de bajo grado tienen un mejor pronóstico que los gliomas anaplásicos y, aún más, que los glioblastomas (los procesos tumorales más desfavorables). Los astrocitomas tienen un peor pronóstico que los oligodendrogliomas.
Los astrocitomas malignos responden mal al tratamiento y tienen una tasa de supervivencia relativamente baja, de seis a cinco años. Al mismo tiempo, la esperanza de vida de los gliomas de bajo grado se estima entre uno y diez años.
Los astrocitomas malignos son prácticamente incurables. El tratamiento suele centrarse en reducir las manifestaciones neurológicas (incluida la disfunción cognitiva) y aumentar la esperanza de vida, manteniendo la máxima calidad de vida posible. La terapia sintomática se complementa con medidas de rehabilitación. La intervención de un psicólogo también es importante.
Durante la última década, los científicos han avanzado en la comprensión de la naturaleza de los tumores cerebrales y su tratamiento. Se debe hacer mucho más para optimizar el pronóstico de la enfermedad. La principal tarea de los especialistas hoy en día es la siguiente: el glioma cerebral debe contar con varios esquemas para la eliminación eficaz del problema de una sola vez, tanto en las etapas iniciales como posteriores de su desarrollo.

