Médico experto del artículo.
Nuevos artículos
Patogénesis de la hepatitis B
Último revisado: 07.07.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
En la patogenia de la hepatitis B se pueden identificar varios eslabones principales de la cadena patogénica:
- introducción del patógeno - infección;
- fijación en el hepatocito y penetración en la célula;
- multiplicación del virus y su “expulsión” a la superficie del hepatocito, así como a la sangre;
- activación de reacciones inmunológicas destinadas a eliminar el patógeno;
- daños causados por complejos inmunes a órganos y sistemas;
- formación de inmunidad, liberación del patógeno, recuperación.
Dado que la infección por hepatitis B siempre se produce por vía parenteral, se puede considerar que el momento de la infección es prácticamente equivalente a la penetración del virus en la sangre. Los intentos de algunos investigadores de distinguir las fases enteral y regional en la hepatitis B carecen de fundamento. Hay más motivos para creer que el virus entra inmediatamente en el hígado a través del flujo sanguíneo.
El tropismo del virus de la hepatitis B hacia el tejido hepático está predeterminado por la presencia de un receptor específico en el HBsAg, un polipéptido con un peso molecular de 31 000 Da (P31), que posee actividad de unión a la albúmina. Una zona de albúmina similar también se encuentra en la membrana de los hepatocitos del hígado de humanos y chimpancés, lo que determina esencialmente el tropismo del VHB hacia el hígado de humanos y chimpancés.
Cuando el virus penetra en el hepatocito, se libera ADN viral. Este, al entrar en el núcleo del hepatocito y actuar como matriz para la síntesis de ácidos nucleicos, desencadena una serie de reacciones biológicas secuenciales, cuyo resultado es el ensamblaje de la nucleocápside del virus. Esta migra a través de la membrana nuclear hacia el citoplasma, donde se produce el ensamblaje final de las partículas de Dane: el virus de la hepatitis B completo.
Sin embargo, cabe señalar que cuando un hepatocito se infecta, el proceso puede ocurrir de dos maneras: replicativa e integrativa. En el primer caso, se desarrolla un cuadro de hepatitis aguda o crónica, y en el segundo, la portación del virus.
No se han establecido con precisión las razones que determinan los dos tipos de interacción entre el ADN viral y los hepatocitos. Lo más probable es que el tipo de respuesta esté determinado genéticamente.
El resultado de la interacción replicativa es el ensamblaje de las estructuras antigénicas centrales (en el núcleo) y el ensamblaje del virus completo (en el citoplasma), seguido de la presentación del virus completo o sus antígenos en la membrana o en la estructura de la membrana del hepatocito.
Se acepta generalmente que la replicación viral no produce daño celular a nivel de los hepatocitos, ya que el virus de la hepatitis B no tiene efecto citopático. Esta postura no puede considerarse indiscutible, ya que se basa en datos experimentales que, si bien indican la ausencia de efecto citopático del virus de la hepatitis B, se obtuvieron en cultivos de tejidos y, por lo tanto, no pueden extrapolarse completamente a la hepatitis B viral en humanos. En cualquier caso, la cuestión de la ausencia de daño a los hepatocitos durante la fase replicativa requiere estudios adicionales.
Sin embargo, independientemente de la naturaleza de la interacción del virus con la célula, el hígado participa necesariamente en el proceso inmunopatológico. En este caso, el daño a los hepatocitos se asocia a que, como resultado de la expresión de antígenos virales en la membrana del hepatocito y su liberación a la circulación libre, se desencadena una cadena de reacciones inmunitarias celulares y humorales secuenciales, cuyo objetivo final es eliminar el virus del organismo. Este proceso se lleva a cabo en total conformidad con los patrones generales de la respuesta inmunitaria a las infecciones virales. Para eliminar el patógeno, se desencadenan reacciones citotóxicas celulares, mediadas por diversas clases de células efectoras: células K, células T, células asesinas naturales y macrófagos. Durante estas reacciones, los hepatocitos infectados se destruyen, lo que se acompaña de la liberación de antígenos virales (HBcAg, HBeAg, HBsAg), que desencadenan el sistema de génesis de anticuerpos, lo que resulta en la acumulación de anticuerpos específicos en la sangre, principalmente contra el núcleo (anti-HBc) y el antígeno e (anti-HBE). En consecuencia, la liberación de la célula hepática del virus se produce en el proceso de su muerte debido a las reacciones de citólisis celular.
Al mismo tiempo, los anticuerpos específicos que se acumulan en la sangre se unen a los antígenos del virus, formando inmunocomplejos que son fagocitados por los macrófagos y excretados por los riñones. En este caso, pueden presentarse diversas lesiones por inmunocomplejos, como glomerulonefritis, arteritis, artralgias, erupciones cutáneas, etc. Con la participación de los anticuerpos específicos, el organismo se depura del patógeno y se produce la recuperación completa.
De acuerdo con el concepto de la patogénesis de la hepatitis B, la diversidad de variantes clínicas en el curso de la enfermedad suele explicarse por las peculiaridades de la interacción del virus y la cooperación de las células inmunocompetentes; es decir, por la intensidad de la respuesta inmunitaria a la presencia de antígenos virales. Según conceptos modernos, la intensidad de la respuesta inmunitaria está determinada genéticamente y vinculada a los antígenos de histocompatibilidad del locus HLA de primera clase.
Se acepta generalmente que, en condiciones de una respuesta inmunitaria adecuada a los antígenos virales, la hepatitis aguda se desarrolla clínicamente con un curso cíclico y recuperación completa. En el contexto de una disminución de la respuesta inmunitaria a los antígenos virales, la citólisis inmunomediada se expresa de forma insignificante; por lo tanto, no hay una eliminación efectiva de las células hepáticas infectadas, lo que conduce a manifestaciones clínicas leves con persistencia prolongada del virus y, posiblemente, al desarrollo de hepatitis crónica. Por el contrario, en caso de una respuesta inmunitaria fuerte, genéticamente determinada, y una infección masiva (hemotransfusión), aparecen extensas áreas de daño hepático, que clínicamente corresponden a formas graves y malignas de la enfermedad.
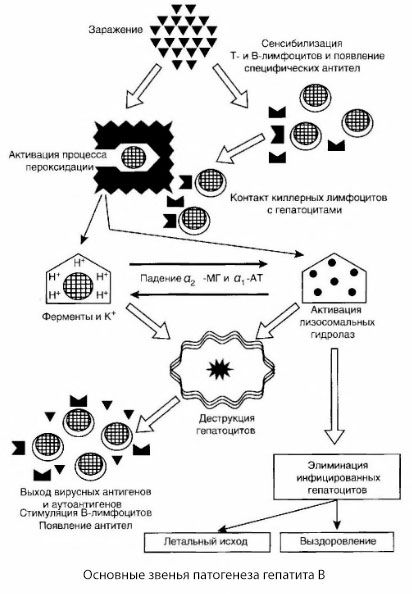
El esquema presentado de la patogénesis de la hepatitis B se distingue por su coherencia; sin embargo, contiene una serie de puntos controvertidos y poco estudiados.
Si consideramos la hepatitis B como una enfermedad inmunopatológica, cabría esperar un aumento de las reacciones de citotoxicidad celular con la gravedad de la enfermedad. Sin embargo, en las formas graves, los índices de inmunidad celular se reducen drásticamente, incluyendo una disminución múltiple, en comparación con los de niños sanos, y el índice de citotoxicidad de las células K. En la forma maligna, durante el desarrollo de necrosis hepática masiva y, especialmente, coma hepático, se observa una incapacidad total de los linfocitos para la transformación blástica bajo la influencia de fitohemaglutinina, endotoxina estafilocócica y HBsAg. Además, los leucocitos no pueden migrar según la reacción de inhibición de la migración leucocitaria (LMIC), y se revela un marcado aumento de la permeabilidad de las membranas linfocitarias según los resultados de sus estudios con una sonda fluorescente de tetraciclina.
Así, si los índices de fluorescencia de los linfocitos en personas sanas son del 9,9 ± 2 %, y en la hepatitis B típica con un curso benigno aumentan al 22,3 ± 2,7 %, entonces en las formas malignas el número de linfocitos fluorescentes alcanza un promedio del 63,5 ± 5,8 %. Dado que un aumento en la permeabilidad de las membranas celulares se evalúa inequívocamente en la literatura como un indicador confiable de su inferioridad funcional, se puede concluir que con la hepatitis B, especialmente en la forma maligna, hay un daño grave a los linfocitos. Esto también se evidencia por los índices de citotoxicidad de las células K. En una forma grave, en la 1-2 semana de la enfermedad, la citotoxicidad es del 15,5 ± 8,8 %, y en la forma maligna en la 1.ª semana - 6,0 ± 2,6, en la 2.ª - 22,0 ± 6,3 % con una norma del 44,8 ± 2,6 %.
Los datos presentados indican claramente alteraciones pronunciadas en el vínculo celular de la inmunidad en pacientes con formas graves de hepatitis B. También es obvio que estos cambios ocurren de forma secundaria, como resultado del daño a las células inmunocompetentes por metabolitos tóxicos y, posiblemente, complejos inmunes circulantes.
Como han demostrado los estudios, en pacientes con formas graves de hepatitis B, especialmente en el caso del desarrollo de necrosis hepática masiva, el título de HBsAg y HBeAg en el suero sanguíneo disminuye y, al mismo tiempo, los anticuerpos contra el antígeno de superficie comienzan a detectarse en títulos altos, lo que es completamente inusual para las formas benignas de la enfermedad, en las que los anti-VHB aparecen solo en el tercer o quinto mes de la enfermedad.
La rápida desaparición de los antígenos del virus de la hepatitis B con la aparición simultánea de altos títulos de anticuerpos antivirales sugiere la formación intensiva de complejos inmunes y su posible participación en la patogénesis del desarrollo de la necrosis hepática masiva.
Por lo tanto, los datos fácticos no permiten interpretar la hepatitis B de forma inequívoca únicamente desde el punto de vista de la agresión inmunopatológica. Y la cuestión no es solo que no se encuentre una conexión entre la profundidad y la prevalencia de los cambios morfológicos en el hígado, por un lado, y la gravedad de los factores de inmunidad celular, por otro. Teóricamente, esta circunstancia podría explicarse por las últimas etapas del estudio de los indicadores de inmunidad celular, cuando las células inmunocompetentes se vieron sometidas a potentes efectos tóxicos debido a la creciente insuficiencia funcional del hígado. Por supuesto, cabe suponer que la citólisis inmunitaria de los hepatocitos ocurre en las etapas más tempranas del proceso infeccioso, posiblemente incluso antes de la aparición de síntomas clínicos de daño hepático grave. Sin embargo, tal suposición es poco probable, ya que se detectaron indicadores similares de inmunidad celular en pacientes con el curso más agudo (relámpago) de la enfermedad y, además, durante el examen morfológico del tejido hepático, no se detectó infiltración linfocítica masiva, mientras que al mismo tiempo, se detectaron campos continuos de epitelio necrótico sin los fenómenos de reabsorción y agresión linfocítica.
Es muy difícil explicar el cuadro morfológico de la hepatitis aguda solo desde el punto de vista de la citólisis celular inmune, por lo tanto, en los primeros estudios no se excluyó el efecto citotóxico del virus de la hepatitis B.
Actualmente, esta suposición se ha confirmado parcialmente con el descubrimiento del virus de la hepatitis B. Según estudios, la frecuencia de detección de marcadores de hepatitis D depende directamente de la gravedad de la enfermedad: en formas leves, se detectan en el 14% de los pacientes; en formas moderadas, en el 18%; en formas graves, en el 30%; y en formas malignas, en el 52%. Considerando que el virus de la hepatitis D tiene un efecto citopático necrosógeno, se puede considerar establecido que la coinfección con los virus de las hepatitis B y D es de gran importancia en el desarrollo de formas fulminantes de hepatitis B.
La patogenia de la hepatitis B se puede presentar de la siguiente manera: tras la penetración del virus de la hepatitis B en los hepatocitos, las células T-killers inducen un ataque inmunológico contra los hepatocitos infectados, que secretan linfotoxinas hacia las células hepáticas.
Los mecanismos internos del daño hepatocítico en la hepatitis B aún no se han establecido. El papel principal lo desempeñan los procesos activados de peroxidación lipídica e hidrolasas lisosomales. El desencadenante podrían ser las linfotoxinas liberadas por las células efectoras al entrar en contacto con los hepatocitos, pero es posible que el propio virus sea el iniciador de los procesos de peroxidación. Posteriormente, el proceso patológico probablemente se desarrolla en la siguiente secuencia.
- Interacción del factor de agresión (linfotoxinas o virus) con macromoléculas biológicas (posiblemente con componentes de las membranas del retículo endoplasmático capaces de participar en procesos de desintoxicación, por analogía con otros agentes dañinos, como se demostró en relación al tetracloruro de carbono).
- Formación de radicales libres, activación de procesos de peroxidación lipídica y aumento de la permeabilidad de todas las membranas hepatocelulares (síndrome de citólisis).
- Movimiento de sustancias biológicamente activas a lo largo del gradiente de concentración: pérdida de enzimas de diversas localizaciones intracelulares, donadores de energía, potasio, etc. Acumulación de sodio y calcio en las células, cambio del pH hacia la acidosis intracelular.
- Activación y liberación de hidrolasas lisosomales (ARNasa, ADNasa, catepsinas, etc.) con la degradación de las células hepáticas y la liberación de autoantígenos.
- Estimulación de los sistemas inmunes T y B con formación de sensibilización específica de los linfocitos T a la lipoproteína hepática, así como formación de autoanticuerpos humorales antihepáticos.
En el esquema propuesto de patogénesis de la hepatitis B, el factor desencadenante son los antígenos virales, cuya producción intensiva se observa en las primeras etapas de la enfermedad y durante todo el período agudo, con excepción de las formas malignas, en las que la producción de antígenos virales prácticamente cesa en el momento del desarrollo de la necrosis hepática masiva, que predetermina una rápida disminución de la replicación viral.
También es evidente que los antígenos virales activan los sistemas inmunitario T y B. Durante este proceso, se produce una redistribución característica de las subpoblaciones de linfocitos T, con el objetivo de organizar una respuesta inmunitaria adecuada, eliminar los hepatocitos infectados, neutralizar los antígenos virales, lograr la sanogénesis y la recuperación.
Cuando las células inmunocompetentes interactúan con antígenos virales en las membranas de los hepatocitos o durante la reproducción del virus dentro de un hepatocito, surgen las condiciones para la activación de los procesos de peroxidación lipídica, que, como se sabe, controla la permeabilidad de todas las membranas celulares y subcelulares.
Desde esta posición, se comprende la aparición del síndrome de citólisis, un aumento de la permeabilidad de las membranas celulares, tan natural y característico de las hepatitis virales.
El resultado final del síndrome de citólisis puede ser la disociación completa de la fosforilación oxidativa, la pérdida de material celular y la muerte del parénquima hepático.
Sin embargo, en la gran mayoría de los casos, estos procesos no adquieren una evolución tan fatal. Solo en las formas malignas de la enfermedad, el proceso patológico avanza de forma progresiva e irreversible, debido a una infección masiva, un proceso inmunitario pronunciado, una activación excesiva de los procesos de peroxidación e hidrodasas lisosomales, y fenómenos de agresión autoinmune.
Los mismos mecanismos se observan en la evolución favorable de la hepatitis B, con la única peculiaridad de que todos se realizan a un nivel cualitativamente diferente. A diferencia de los casos de necrosis hepática masiva, en la evolución favorable de la enfermedad, el número de hepatocitos infectados y, por lo tanto, la zona de citólisis inmunopatológica es menor; los procesos de peroxidación lipídica no se intensifican significativamente; la activación de las hidrolasas ácidas conduce solo a una autólisis limitada con una liberación insignificante de autoantígenos y, por lo tanto, sin autoagresión masiva. Es decir, todas las etapas de la patogénesis en la evolución favorable se llevan a cabo dentro del marco de la organización estructural preservada del parénquima hepático y están restringidas por sistemas de defensa (antioxidantes, inhibidores, etc.), por lo que no tienen un efecto tan destructivo.
Las causas de los síntomas de intoxicación en la hepatitis viral no se han estudiado a fondo. La propuesta de distinguir entre la denominada intoxicación primaria o viral y la secundaria (de intercambio o metabólica) puede considerarse positiva, aunque esto no revela el mecanismo íntimo de la aparición del síndrome tóxico general. En primer lugar, los virus de la hepatitis no tienen propiedades tóxicas y, en segundo lugar, la concentración de muchos metabolitos no siempre se correlaciona con la gravedad de la enfermedad ni con el grado de expresión de los síntomas de toxicosis. También se sabe que la concentración de antígenos virales no se correlaciona estrictamente con la gravedad de la intoxicación. Por el contrario, con un aumento de la gravedad de la enfermedad y, por lo tanto, del grado de toxicosis, la concentración de HBsAg disminuye y alcanza su nivel más bajo en las formas malignas al inicio del coma hepático profundo. Al mismo tiempo, la frecuencia de detección y los títulos de anticuerpos antivirales específicos dependen directamente de la gravedad de la enfermedad.
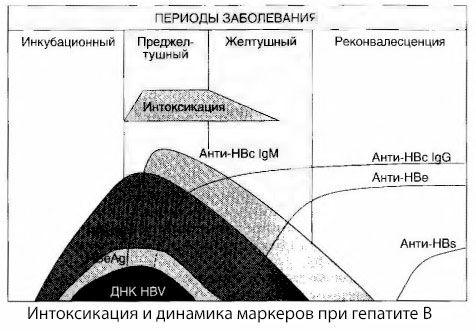
La intoxicación no se manifiesta en el momento del registro de antígenos virales, sino durante la circulación sanguínea de anticuerpos antivirales de clase IgM contra el antígeno de vaca y el antígeno del sistema E. Además, en las formas graves y, sobre todo, malignas, un porcentaje significativo de pacientes presenta incluso anticuerpos anti-HBs en sangre, algo que no suele observarse en las formas leves y moderadas de la enfermedad.
Los datos presentados permiten concluir que el síndrome de toxicosis en la hepatitis viral, y en particular en la hepatitis B, no se produce como resultado de la presencia de antígenos virales en la sangre, sino como consecuencia de la interacción de estos con anticuerpos antivirales de la clase IgM. Como es sabido, el resultado de dicha interacción es la formación de inmunocomplejos y, posiblemente, de sustancias tóxicas activas.
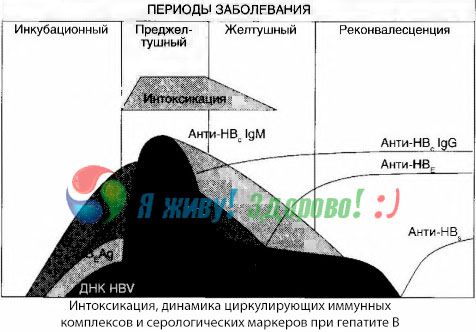
Los síntomas de intoxicación surgen en el momento de la aparición de los complejos inmunes en la libre circulación, pero posteriormente no se observa tal correlación.
Una explicación parcial de esto se encuentra en el estudio de la composición de los inmunocomplejos. En pacientes con formas graves, circulan en la sangre principalmente complejos de tamaño mediano, y en su composición, durante el auge del síndrome tóxico, predominan los anticuerpos de esta clase, mientras que durante el período de disminución de las manifestaciones clínicas y la convalecencia, los complejos se vuelven más grandes y comienzan a predominar los anticuerpos de la clase IgG.
Los datos presentados se refieren a los mecanismos de desarrollo del síndrome tóxico en el período inicial de la enfermedad, pero en la toxicosis que ocurre en el apogeo de las manifestaciones clínicas, tienen sólo una importancia parcial, y especialmente en el desarrollo del coma hepático.
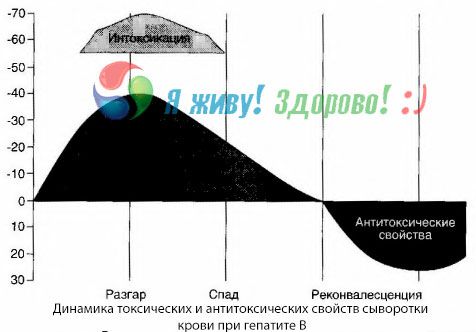
El método de hemocultivos ha demostrado que, en la hepatitis B, las toxinas se acumulan constantemente en la sangre, liberadas por el tejido hepático dañado y en descomposición. La concentración de estas toxinas es proporcional a la gravedad de la enfermedad y son de naturaleza proteica.
Durante el período de recuperación, aparecen anticuerpos contra esta toxina en la sangre; pero en caso de coma hepático, la concentración de la toxina en la sangre aumenta bruscamente y no se detectan anticuerpos en la sangre.
Patomorfología de la hepatitis B
Según la naturaleza de los cambios morfológicos, se distinguen tres formas de hepatitis B aguda:
- forma cíclica,
- necrosis hepática masiva;
- hepatitis pericolangiolítica colestásica.
En la forma cíclica de la hepatitis B, los cambios distróficos, inflamatorios y proliferativos son más pronunciados en el centro de los lobulillos, mientras que en la hepatitis A se localizan en la periferia del lobulillo y se propagan hacia el centro. Estas diferencias se explican por las distintas vías de penetración del virus en el parénquima hepático. El virus de la hepatitis A entra en el hígado a través de la vena porta y se propaga hacia el centro de los lobulillos; el virus de la hepatitis B penetra a través de la arteria hepática y las ramas capilares, que irrigan uniformemente todos los lobulillos hasta su centro.
En la mayoría de los casos, el grado de daño al parénquima hepático se corresponde con la gravedad de las manifestaciones clínicas de la enfermedad. En las formas leves, suele observarse necrosis focal de los hepatocitos, y en las formas moderadas y graves, necrosis zonal (con tendencia a fusionarse y formar necrosis en puente en las formas graves).
Los mayores cambios morfológicos en el parénquima se observan en el punto álgido de las manifestaciones clínicas, que suele coincidir con la primera década de la enfermedad. Durante la segunda y, sobre todo, la tercera década, los procesos de regeneración se intensifican. En este período, los cambios necrobióticos desaparecen casi por completo y los procesos de infiltración celular comienzan a predominar, con una lenta restauración posterior de la estructura de las placas hepatocelulares. Sin embargo, la restauración completa de la estructura y la función del parénquima hepático ocurre solo entre 3 y 6 meses después del inicio de la enfermedad y no en todos los pacientes.
El carácter generalizado de la infección en la hepatitis B se confirma mediante la detección de HBsAg no sólo en los hepatocitos, sino también en los riñones, pulmones, bazo, páncreas, células de la médula ósea, etc.
La hepatitis colestásica (pericolangiolítica) es una forma especial de la enfermedad, en la que los mayores cambios morfológicos se observan en los conductos biliares intrahepáticos, con un cuadro de colangiolitis y pericolangiolitis. En la forma colestásica, la colestasis se produce con dilatación de los capilares biliares con estasis biliar, proliferación de colangiolos e infiltrados celulares a su alrededor. Las células hepáticas se ven afectadas de forma insignificante en esta forma de hepatitis. Clínicamente, la enfermedad se caracteriza por una evolución prolongada con ictericia prolongada. Se ha demostrado que la causa de esta peculiar evolución de la enfermedad es el efecto predominante del virus sobre las paredes del colangiolo, con un efecto insignificante sobre los hepatocitos.

