Médico experto del artículo.
Nuevos artículos
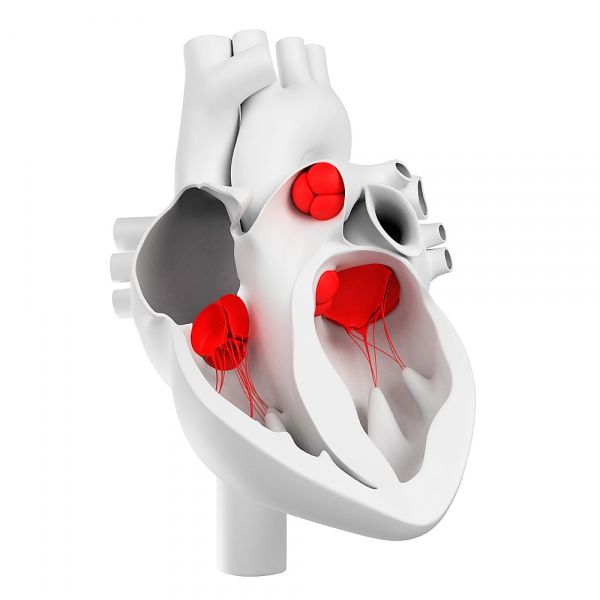
Válvulas cardíacas
Último revisado: 04.07.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
Anteriormente se creía que todas las válvulas cardíacas eran estructuras simples cuya contribución al flujo sanguíneo unidireccional residía simplemente en el movimiento pasivo en respuesta a un gradiente de presión aplicado. Esta comprensión de las "estructuras pasivas" condujo al desarrollo de sustitutos valvulares mecánicos y biológicos "pasivos".
Cada vez es más evidente que las válvulas cardíacas tienen una estructura y función más complejas. Por lo tanto, la creación de un sustituto valvular cardíaco "activo" presupone una similitud significativa en estructura y función con la válvula cardíaca natural, lo cual en el futuro es bastante factible gracias al desarrollo de la ingeniería de tejidos.
Las válvulas cardíacas se desarrollan a partir de rudimentos embrionarios de tejido mesenquimal durante la formación del endocardio. Durante la morfogénesis, se forman el canal auriculoventricular (válvulas cardíacas tricúspide y mitral) y el tracto de salida ventricular (válvulas cardíacas aórtica y pulmonar).
¿Cómo están dispuestas las válvulas del corazón?
El estudio del suministro de sangre a las válvulas fue iniciado por N. Luschka (1852), quien inyectó una masa de contraste en los vasos cardíacos. Descubrió numerosos vasos sanguíneos en las cúspides de las válvulas auriculoventriculares y semilunares de la aorta y la arteria pulmonar. Al mismo tiempo, varios manuales de anatomía patológica e histología contenían indicaciones de que las válvulas cardíacas humanas inalteradas no contienen vasos sanguíneos, y estos aparecen en las válvulas solo en diversos procesos patológicos: aterosclerosis y endocarditis de diversas etiologías. La información sobre la ausencia de vasos sanguíneos se basó principalmente en estudios histológicos. Se asumió que, en ausencia de vasos sanguíneos en la parte libre de las cúspides, su nutrición ocurre al filtrar el líquido del plasma sanguíneo que lava las cúspides. Se observó la penetración de algunos vasos junto con fibras de tejido muscular estriado en las bases de las válvulas y los tendones.
Sin embargo, al inyectar en los vasos cardíacos diversos colorantes (tinta china en gelatina, bismuto en gelatina, suspensión acuosa de tinta china negra, soluciones de carmín o azul tripán), se encontró que los vasos penetran en las válvulas cardíacas auriculoventriculares, las válvulas aórticas y la arteria pulmonar junto con el tejido muscular cardíaco, un poco antes de alcanzar el borde libre de la válvula.
En el tejido conectivo fibroso laxo de las cúspides de las válvulas auriculoventriculares se encontraron vasos principales individuales que se anastomosaban con vasos en áreas adyacentes de tejido muscular estriado cardíaco.
El mayor número de vasos sanguíneos se localizaba en la base y un número comparativamente menor en la parte libre de estas válvulas.
Según KI Kulchitsky et al. (1990), la válvula mitral presenta un mayor diámetro de vasos arteriales y venosos. En la base de las cúspides de esta válvula se localizan principalmente los vasos principales con una red de capilares de asa estrecha, que penetran en la parte basal de la cúspide y ocupan el 10% de su área. En la válvula tricúspide, los vasos arteriales tienen un diámetro menor que en la válvula mitral. En las cúspides de esta válvula, se encuentran principalmente vasos dispersos y asas capilares comparativamente anchas. En la válvula mitral, la cúspide anterior recibe un riego sanguíneo más intenso, mientras que en la válvula tricúspide, las cúspides anterior y posterior, que realizan la principal función de cierre. La relación de los diámetros de los vasos arteriales y venosos en las válvulas auriculoventriculares del corazón de personas mayores es de 1:1,5. Las asas capilares son poligonales y se ubican perpendiculares a la base de las cúspides valvulares. Los vasos forman una red plana ubicada bajo el endotelio en el lado auricular. Los vasos sanguíneos también se encuentran en las cuerdas tendinosas, donde penetran desde los músculos papilares de los ventrículos derecho e izquierdo a una distancia de hasta el 30% de la longitud de las cuerdas tendinosas. Numerosos vasos sanguíneos forman bucles arqueados en la base de las cuerdas tendinosas. Las válvulas cardíacas de la aorta y el tronco pulmonar difieren significativamente de las válvulas auriculoventriculares en términos de suministro de sangre. Los vasos principales de un diámetro relativamente menor se aproximan a la base de las cúspides semilunares de las válvulas aórtica y del tronco pulmonar. Las ramas cortas de estos vasos terminan en bucles capilares de forma ovalada y poligonal irregular. Se ubican principalmente cerca de la base de las cúspides semilunares. Los vasos venosos en la base de las válvulas aórtica y pulmonar también tienen un diámetro menor que los de la base de las válvulas auriculoventriculares. La relación entre los diámetros de los vasos arteriales y venosos en las válvulas aórtica y pulmonar del corazón de personas mayores es de 1:1,4. De los vasos más grandes se extienden ramas laterales cortas que terminan en asas de capilares de formas ovaladas y poligonales irregulares.

Con la edad, se produce un engrosamiento de las fibras del tejido conectivo, tanto de colágeno como elásticas, así como una disminución de la cantidad de tejido conectivo fibroso laxo no formado, y se desarrolla esclerosis del tejido de las cúspides de las válvulas auriculoventriculares y semilunares de las válvulas aórtica y pulmonar. La longitud de las fibras musculares estriadas cardíacas en las válvulas disminuye y, en consecuencia, su cantidad y el número de vasos sanguíneos que las penetran. Debido a estos cambios, las válvulas cardíacas pierden sus propiedades elásticas y resilientes, lo que afecta el mecanismo de cierre valvular y la hemodinámica.
Las válvulas cardíacas poseen redes de capilares linfáticos y una pequeña cantidad de vasos linfáticos provistos de válvulas. Los capilares linfáticos de las cúspides presentan una apariencia característica: su luz es muy irregular, y el mismo capilar, en diferentes zonas, presenta un diámetro distinto. En la confluencia de varios capilares, se forman expansiones (lagunas) de diversas formas. Los bucles de las redes suelen ser poligonales irregulares, y con menor frecuencia ovalados o redondos. A menudo, los bucles de las redes linfáticas no están cerrados y los capilares linfáticos terminan ciegamente. Los bucles de los capilares linfáticos se orientan con mayor frecuencia desde el borde libre de la cúspide hasta su base. En algunos casos, se encontró una red de dos capas de capilares linfáticos en las cúspides de la válvula auriculoventricular.
Los plexos nerviosos endocárdicos se ubican en sus diversas capas, principalmente bajo el endotelio. En el borde libre de las valvas, las fibras nerviosas se ubican principalmente radialmente, conectando con las de las cuerdas tendinosas. Más cerca de la base de las valvas, se forma un plexo nervioso de malla ancha, que conecta con el plexo ubicado alrededor de los anillos fibrosos. En las valvas semilunares, la red nerviosa endocárdica es más dispersa. En el punto de inserción de las valvas, se vuelve densa y multicapa.
Estructura celular de las válvulas cardíacas
Las células intersticiales valvulares, responsables de mantener la estructura de la válvula, presentan una forma alargada con numerosos procesos finos que se extienden por toda la matriz valvular. Existen dos poblaciones de células intersticiales valvulares que difieren en morfología y estructura: una presenta propiedades contráctiles y se caracteriza por la presencia de fibrillas contráctiles, y la otra, propiedades secretoras y un retículo endoplasmático y un aparato de Golgi bien desarrollados. La función contráctil resiste la presión hemodinámica y se ve reforzada por la producción de proteínas contráctiles cardíacas y esqueléticas, entre las que se incluyen las cadenas pesadas de alfa y beta-miosina y diversas isoformas de troponina. Se ha demostrado que la contracción de la valva de la válvula cardíaca responde a diversos agentes vasoactivos, lo que sugiere un estímulo biológico coordinado para el correcto funcionamiento de la válvula.
Las células intersticiales también son componentes esenciales del sistema de reparación de estructuras como las válvulas cardíacas. El movimiento constante de las valvas y la deformación asociada del tejido conectivo producen daños a los que las células intersticiales valvulares responden para mantener la integridad de la válvula. El proceso de reparación parece ser vital para el funcionamiento normal de la válvula, y la ausencia de estas células en los modelos actuales de válvulas artificiales probablemente sea un factor que contribuya al daño estructural de las bioprótesis.
Un área importante de investigación en células intersticiales es el estudio de las interacciones entre estas y la matriz circundante, mediadas por moléculas de adhesión focal. Las adhesiones focales son sitios especializados de interacción célula-matriz que unen el citoesqueleto celular con las proteínas de la matriz mediante integrinas. También actúan como sitios de transducción de señales, transmitiendo información mecánica desde la matriz extracelular que puede generar respuestas, incluyendo, entre otras, la adhesión celular, la migración, el crecimiento y la diferenciación. Comprender la biología celular de las células intersticiales valvulares es vital para dilucidar los mecanismos mediante los cuales estas células interactúan entre sí y con su entorno, de modo que esta función pueda recapitularse en válvulas artificiales.
En relación con el desarrollo de una prometedora dirección de ingeniería tisular de válvulas cardíacas, se llevan a cabo estudios de células intersticiales utilizando una amplia gama de técnicas. La presencia del citoesqueleto celular se confirma mediante tinción para vimentina, desmina, troponina, alfa-actina y miosina de músculo liso, cadenas pesadas de alfa- y beta-miosina, cadenas ligeras-2 de miosina cardíaca, alfa- y beta-tubulina. La contractilidad celular se confirma mediante una respuesta positiva a epinefrina, angiotensina II, bradicinina, carbacol, cloruro de potasio y endotelio I. Las interrelaciones celulares se determinan mediante interacciones funcionales y se verifican mediante microinyecciones de carboxifluoresceína. La secreción de la matriz se establece mediante tinción para prolil-4-hidroxilasa/colágeno tipo II, fibronectina, sulfato de condroitina y laminina. La inervación se establece por la proximidad de las terminaciones nerviosas motoras, lo cual se refleja en la actividad del neuropéptido Y, la tirosina hidroxilasa, la acetilcolinesterasa, el polipéptido intestinal vasoactivo, la sustancia P y el péptido relacionado con el gen del capsicum. Los factores mitogénicos se estiman mediante el factor de crecimiento derivado de plaquetas, el factor de crecimiento básico de fibroblastos y la serotonina (5-HT). Los fibroblastos de células intersticiales estudiados se caracterizan por una membrana basal incompleta, procesos citoplasmáticos largos y delgados, una estrecha conexión con la matriz, un retículo endoplasmático irregular bien desarrollado y un aparato de Golgi, abundancia de microfilamentos y formación de enlaces adhesivos.
Las células endocárdicas valvulares forman una vaina atrombogénica funcional alrededor de cada válvula cardíaca, similar al endotelio vascular. El método ampliamente utilizado de reemplazo valvular elimina la función protectora del endocardio, lo que puede provocar el depósito de plaquetas y fibrina en las válvulas artificiales, el desarrollo de infecciones bacterianas y la calcificación tisular. Otra función probable de estas células es la regulación de las células intersticiales valvulares subyacentes, similar a la regulación de las células musculares lisas por el endotelio. Existen interacciones complejas entre el endotelio y las células adyacentes, mediadas en parte por factores solubles secretados por las células endoteliales. Estas células forman una gran superficie cubierta de microprotuberancias en el lado luminal, lo que aumenta la exposición y la posible interacción con sustancias metabólicas en la sangre circulante.
El endotelio a menudo presenta diferencias morfológicas y funcionales causadas por las tensiones de cizallamiento en la pared vascular debido al flujo sanguíneo, y esto también aplica a las células endocárdicas valvulares, que adoptan una forma alargada o poligonal. Los cambios en la estructura celular pueden ocurrir debido a la acción de la hemodinámica local sobre los componentes del citoesqueleto celular o a efectos secundarios causados por cambios en la matriz extracelular subyacente. A nivel ultraestructural, las células endocárdicas valvulares poseen conexiones intercelulares, vesículas plasmáticas, un retículo endoplasmático rugoso y un aparato de Golgi. Aunque producen factor de von Willebrand tanto in vivo como in vitro, carecen de cuerpos de Weibel-Palade (gránulos específicos que contienen factor de von Willebrand), que son orgánulos característicos del endotelio vascular. Las células endocárdicas valvulares se caracterizan por uniones fuertes, interacciones funcionales de gap y pliegues marginales superpuestos.
Las células endocárdicas conservan su actividad metabólica incluso in vitro: producen factor de von Willebrand, prostaciclina, óxido nítrico sintasa, presentan actividad de la enzima convertidora de angiotensina y secretan intensamente las moléculas de adhesión ICAM-1 y ELAM-1, importantes para la unión de células mononucleares durante el desarrollo de la respuesta inmunitaria. Todos estos marcadores deben tenerse en cuenta al desarrollar un cultivo celular ideal para crear una válvula artificial mediante ingeniería tisular, pero el potencial inmunoestimulante de las propias células endocárdicas valvulares puede limitar su uso.
La matriz extracelular de las válvulas cardíacas está compuesta por macromoléculas fibrosas de colágeno y elastina, proteoglicanos y glicoproteínas. El colágeno representa el 60% del peso seco de la válvula, la elastina el 10% y los proteoglicanos el 20%. El componente de colágeno proporciona la principal estabilidad mecánica de la válvula y está representado por colágenos de tipos I (74%), II (24%) y V (2%). Los haces de hilos de colágeno están rodeados por una vaina de elastina, que media las interacciones entre ellos. Las cadenas laterales de glicosaminoglicano de las moléculas de proteoglicanos tienden a formar una sustancia gelatinosa en la que otras moléculas de la matriz interactúan para formar enlaces permanentes y se depositan otros componentes. Los glicosaminoglicanos de las válvulas cardíacas humanas están compuestos principalmente de ácido hialurónico, en menor medida de dermatán sulfato, condroitín-4-sulfato y condroitín-6-sulfato, con una cantidad mínima de heparán sulfato. La remodelación y renovación del tejido de la matriz están reguladas por las metaloproteinasas de matriz (MMP) y sus inhibidores tisulares (TI). Estas moléculas también participan en una gama más amplia de procesos fisiológicos y patológicos. Algunas metaloproteinasas, como las colagenasas intersticiales (MMP-1, MMP-13) y las gelatinasas (MMP-2, MMP-9) y sus inhibidores tisulares (TI-1, TI-2, TI-3), se encuentran en todas las válvulas cardíacas. La producción excesiva de metaloproteinasas es característica de las afecciones patológicas de la válvula cardíaca.
 [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Válvulas cardíacas y su estructura morfológica
Las válvulas cardíacas constan de tres capas morfológicamente diferentes y funcionalmente significativas de la matriz de las valvas: fibrosa, esponjosa y ventricular.
La capa fibrosa forma una estructura resistente a la carga para la valva valvular, compuesta por capas de fibras de colágeno. Estas fibras se disponen radialmente en pliegues para permitir que las válvulas arteriales se estiren al cerrarse. La capa fibrosa se encuentra cerca de la superficie exterior de salida de estas válvulas. La capa fibrosa de las válvulas auriculoventriculares sirve como continuación de los haces de colágeno de las cuerdas tendinosas. Se encuentra entre las capas esponjosa (de entrada) y ventricular (de salida).
Entre las capas fibrosa y ventricular se encuentra la capa esponjosa. Esta capa consiste en tejido conectivo poco organizado en un medio viscoso. Los componentes principales de la matriz de esta capa son proteoglicanos con colágeno de orientación aleatoria y finas capas de elastina. Las cadenas laterales de las moléculas de proteoglicanos poseen una fuerte carga negativa, lo que afecta su alta capacidad para fijar agua y formar un gel poroso en la matriz. La capa esponjosa de la matriz reduce la tensión mecánica en las valvas de las válvulas cardíacas y mantiene su flexibilidad.
La capa ventricular es mucho más delgada que las demás y rica en fibras elásticas que permiten al tejido resistir la deformación constante. La elastina posee una estructura esponjosa que rodea y conecta las fibras de colágeno, manteniéndolas en un estado de plegado neutro. La capa de entrada de la válvula (ventricular en el caso de las válvulas arteriales y esponjosa en el caso de las auriculoventriculares) contiene más elastina que la de salida, lo que suaviza el impacto hidráulico cuando las cúspides se cierran. Esta relación entre el colágeno y la elastina permite que las cúspides se estiren hasta un 40 % sin una deformación estable. Al ser sometidas a una carga leve, las estructuras de colágeno de esta capa se orientan en la dirección de la carga, aumentando así su resistencia a un mayor crecimiento de la misma.
Por lo tanto, la idea de que las válvulas cardíacas son simples duplicaciones endocárdicas no solo es simplificada, sino también esencialmente incorrecta. Las válvulas cardíacas son órganos complejos que incluyen fibras musculares estriadas, vasos sanguíneos y linfáticos, y elementos nerviosos. Tanto en su estructura como en su funcionamiento, las válvulas son parte integral de todas las estructuras cardíacas. El análisis de la función valvular normal debe considerar su organización celular, así como la interacción de las células entre sí y con la matriz. El conocimiento obtenido a partir de estos estudios es pionero en el diseño y desarrollo de prótesis valvulares mediante ingeniería de tejidos.

