Médico experto del artículo.
Nuevos artículos
Virus de la inmunodeficiencia humana (VIH)
Último revisado: 04.07.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
El síndrome de inmunodeficiencia adquirida se identificó como una enfermedad específica en 1981 en Estados Unidos, cuando varios jóvenes desarrollaron enfermedades graves causadas por microorganismos no patógenos o de baja patogenicidad para personas sanas. Un estudio del estado inmunitario de los pacientes reveló una marcada disminución del número de linfocitos en general y de células T cooperadoras en particular. Esta afección se denominó SIDA (Síndrome de Inmunodeficiencia Adquirida). La vía de contagio (contacto sexual, a través de sangre y sus preparaciones) indicó la naturaleza infecciosa de la enfermedad.
El agente causal del SIDA fue descubierto en 1983 de forma independiente por el francés L. Montagnier, que lo denominó LAV Lymphoadenopathy Associated Virus, ya que lo encontró en un paciente con linfadenopatía; y el estadounidense R. Gallo, que lo denominó HTLV-III (Human T-lymphotropic Virus III): anteriormente había descubierto los virus linfotrópicos I y II.
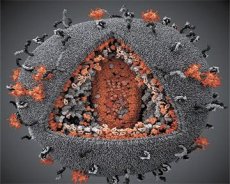
Una comparación de las propiedades de los virus LAV y HTLV-III mostró su identidad, por lo que para evitar confusiones, el virus fue nombrado VIH (Virus de Inmunodeficiencia Humana o VIH) en 1986. El VIH tiene forma esférica, con un diámetro de 110 nm. La envoltura del virus tiene la forma de un poliedro, compuesto por 12 pentágonos y 20 hexágonos. En el centro y las esquinas de cada hexágono hay una molécula de proteína glicosilada gpl20 (el número 120 indica el peso molecular de la proteína en kilodaltons). Un total de 72 moléculas de gpl20 se encuentran en la superficie del virión en forma de picos peculiares, cada uno de los cuales está asociado con la proteína intramembrana gp41. Estas proteínas, junto con la doble capa lipídica, forman la supercápside (membrana) del virión.
Las proteínas gp120 y gp41 se forman mediante el corte de la proteína precursora Env por una proteasa celular. La proteína gp41 forma el "tallo" de la espícula al unirse con su dominio citoplasmático a la proteína matriz p17MA, ubicada directamente debajo de la envoltura. Las moléculas p17 interactúan durante la maduración del virión para formar un icosaedro subyacente a la envoltura.
En la parte central del virión, la proteína p24 forma una cápside cónica. La parte estrecha de la cápside se conecta a la membrana del virión mediante la participación de la proteína rb. Dentro de la cápside, se encuentran dos moléculas idénticas de ARN genómico viral. Están conectadas por sus extremos 5' a la proteína de la nucleocápside p7NC. Esta proteína es interesante porque tiene dos residuos de aminoácidos (motivos) ricos en cisteína e histidina, que contienen un átomo de Zn. Se denominan "dedos de zinc" porque capturan moléculas de ARN genómico para su inclusión en los viriones en formación. La cápside también contiene tres enzimas. La revertasa (RT), o complejo pol, incluye la transcriptasa inversa, la ARNasa H y la ADN polimerasa dependiente de ADN. La revertasa está presente como un heterodímero p66/p51. La proteasa (PR), p10, inicia e implementa el proceso de maduración del virión. La integrasa (IN) p31, o endonucleasa, asegura la inclusión del ADN proviral en el genoma de la célula huésped. La cápside también contiene una molécula de ARN cebador (ARNt 1-3).
El genoma de ARN en la célula se convierte en un genoma de ADN (ADN provirus) mediante la transcriptasa inversa, compuesto por 9283 pares de nucleótidos. Está delimitado a la izquierda y a la derecha por las llamadas repeticiones terminales largas (LTR): S'-LTR a la izquierda y 3'-LTR a la derecha. Cada LTR contiene 638 pares de nucleótidos.
El genoma del VIH consta de nueve genes, algunos de los cuales se superponen en los extremos (tienen varios marcos de lectura) y presentan una estructura de exonintrón. Controlan la síntesis de nueve proteínas estructurales y seis reguladoras.
La importancia de las LTR para el genoma viral es que contienen los siguientes elementos reguladores que controlan su funcionamiento:
- señal de transcripción (región promotora);
- señal de adición de poli-A;
- señal de limitación;
- señal de integración;
- señal de regulación positiva (TAR para la proteína TAT);
- elemento regulador negativo (NRE para la proteína NEF);
- un sitio para la unión del ARN cebador (ARNt™3) para la síntesis de ADN de cadena negativa en el extremo 3'; una señal en el extremo 5' de la LTR que sirve como cebador para la síntesis de ADN de cadena positiva.
Además, el LTR contiene elementos que intervienen en la regulación del empalme del ARNm, el empaquetamiento de las moléculas de ARNv en la cápside (elemento Psi). Finalmente, durante la transcripción genómica, se forman dos señales en los ARNm largos para la proteína REV, que regulan la síntesis de proteínas: CAR (para proteínas reguladoras) y CRS (para proteínas estructurales). Si la proteína REV se une a CAR, se sintetizan proteínas estructurales; si no se une a CAR, solo se sintetizan proteínas reguladoras.
Los siguientes genes reguladores y sus proteínas juegan un papel particularmente importante en la regulación del funcionamiento del genoma del virus:
- Proteína TAT, que realiza el control positivo de la replicación viral y actúa a través de la región reguladora TAR;
- Proteínas NEV y VPU, que ejercen un control negativo de la replicación a través de la región NRE;
- Proteína REV, que realiza el control positivo-negativo. Controla la función de los genes gag, pol y env y realiza la regulación negativa del empalme.
Por tanto, la replicación del VIH está bajo un triple control: positivo, negativo y positivo-negativo.
La proteína VIF determina la infectividad del virus recién sintetizado. Está asociada a la proteína p24 de la cápside y está presente en el virión en una cantidad de 60 moléculas. La proteína NEF está representada en el virión por un pequeño número de moléculas (5-10), posiblemente asociadas a la envoltura.
La proteína VPR inhibe el ciclo celular en la fase G2, participa en el transporte de complejos de preintegración al núcleo celular, activa algunos genes virales y celulares, y aumenta la eficiencia de la replicación viral en monocitos y macrófagos. No se ha determinado la ubicación de las proteínas VPR, TAT, REV y VPU en el virión.
Además de sus propias proteínas, la membrana del virión puede contener algunas proteínas de la célula huésped. Las proteínas VPU y VPR participan en la regulación de la reproducción viral.
Variantes antigénicas del virus de la inmunodeficiencia humana (VIH)
El virus de la inmunodeficiencia humana (VIH) es muy variable. Incluso del mismo paciente, se pueden aislar cepas virales con propiedades antigénicas significativamente diferentes. Esta variabilidad se ve facilitada por la destrucción intensiva de células CD4+ y una potente respuesta de anticuerpos a la infección por VIH. Una nueva forma de VIH, el VIH-2, biológicamente similar al VIH-1 pero inmunológicamente diferente, se ha aislado en pacientes de África Occidental. La homología de la estructura primaria de los genomas de estos virus es del 42%. El ADN del provirus VIH-2 contiene 9671 pb y su LTR, 854 pb. El VIH-2 se aisló posteriormente en otras regiones del mundo. No existe inmunidad cruzada entre el VIH-1 y el VIH-2. Se conocen dos grandes formas de VIH-1: O (Outlier) y M (Major); esta última se divide en 10 subtipos (AJ). En Rusia circulan ocho subtipos (AH).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
El mecanismo de interacción del VIH con la célula
Tras penetrar en el organismo, el virus ataca primero a las células que contienen el receptor CD4 específico. Este receptor está presente en grandes cantidades en los linfocitos T cooperadores y, en menor medida, en los macrófagos y monocitos, siendo los linfocitos T cooperadores especialmente sensibles al virus.
El virus de la inmunodeficiencia humana (VIH) reconoce los receptores CD4 mediante su proteína gp120. El proceso de interacción del VIH con la célula se produce según el siguiente esquema: adsorción mediada por el receptor -> fosa recubierta -> vesícula recubierta -> lisosoma. En ella, la membrana del virión se fusiona con la membrana del lisosoma, y la nucleocápside, liberada de la supercápside, penetra en el citoplasma; de camino al núcleo, se destruye, liberándose el ARN genómico y los componentes centrales asociados. A continuación, la transcriptasa inversa sintetiza la hebra negativa del ADN en el ARN del virión, la ARNasa H destruye el ARN del virión y la ADN polimerasa viral sintetiza la hebra positiva del ADN. Las 5'-LTR y 3'-LTR se forman en los extremos del provirus de ADN. El provirus de ADN puede permanecer inactivo en el núcleo durante un tiempo, pero tarde o temprano se integra en el cromosoma de la célula diana mediante su integrasa. En él, el provirus permanece inactivo hasta que el linfocito T en cuestión es activado por antígenos microbianos u otras células inmunocompetentes. La activación de la transcripción del ADN celular está regulada por un factor nuclear especial (NF-kB). Es una proteína de unión al ADN y se produce en grandes cantidades durante la activación y proliferación de linfocitos T y monocitos. Esta proteína se une a ciertas secuencias de ADN celular y secuencias LTR similares del provirus de ADN e induce la transcripción tanto del ADN celular como del provirus de ADN. Al inducir la transcripción del provirus de ADN, lleva a cabo la transición del virus de un estado inactivo a uno activo y, en consecuencia, de una infección persistente a una productiva. El provirus puede permanecer en un estado inactivo durante mucho tiempo. La activación del virus es un momento crítico en su interacción con la célula.
Desde el momento en que el virus penetra en la célula, comienza el período de infección por VIH (el estado de portador del virus), que puede durar 10 años o más; y desde el momento en que el virus se activa, comienza la enfermedad: el SIDA. Con la ayuda de sus genes reguladores y sus productos, el virus comienza a reproducirse activamente. La proteína TAT puede aumentar la tasa de reproducción del virus hasta 1000 veces. La transcripción viral es compleja e incluye la formación de ARNm completo y subgenómico, el empalme del ARNm y, posteriormente, la síntesis de proteínas estructurales y reguladoras.
La síntesis de proteínas estructurales ocurre de la siguiente manera. Primero, se sintetiza la poliproteína precursora Pr55Gag (una proteína con un peso molecular de 55 kDa). Contiene 4 dominios principales: matriz (MA), cápside (CA), nucleocápside (NC) y el dominio rb, a partir del cual, como resultado del corte de Pr55Gag por la proteasa viral (se autocorta de otra proteína precursora, Gag-Pol), se forman las proteínas estructurales p17, p24, p7 y rb, respectivamente. La formación de la poliproteína Pr55Gag es la condición principal para la formación de partículas virales. Es esta proteína la que determina el programa de morfogénesis del virión. Incluye secuencialmente las etapas de transporte de la poliproteína Gag a la membrana plasmática, la interacción con ella y las interacciones proteína-proteína durante la formación de la partícula viral y su gemación. Pr55Gag se sintetiza en polirribosomas libres; Las moléculas de proteína se transportan a la membrana, donde se anclan mediante sus regiones hidrofóbicas. El dominio CA desempeña un papel fundamental en la creación de la conformación nativa de la proteína Gag. El dominio NC asegura la inclusión (mediante sus "dedos de zinc") de dos moléculas de ARN genómico en la composición de la partícula viral en formación. La molécula de poliproteína se dimeriza inicialmente debido a la interacción de los dominios de la matriz. Posteriormente, los dímeros se combinan en complejos hexaméricos (de 6 unidades) como resultado de la interacción de los dominios CA y NC. Finalmente, los hexámeros, al unirse en sus superficies laterales, forman viriones esféricos inmaduros, en cuyo interior se encuentra el ARN viral genómico, capturado por el dominio NC.
Otra proteína precursora, Prl60Gag-Pol (una proteína con un peso molecular de 160 kDa), se sintetiza como resultado de un desplazamiento del marco de lectura por el ribosoma durante la traducción del extremo 3' del gen gag en la región situada inmediatamente aguas arriba de la región que codifica la proteína rb. Esta poliproteína Gag-Pol contiene una secuencia incompleta de la proteína Gag (1-423 aminoácidos) y secuencias Pol que incluyen los dominios PR, RT e IN. Las moléculas de la poliproteína Gag-Pol también se sintetizan en polirribosomas libres y se transportan a la membrana plasmática. La poliproteína Prl60Gagpol contiene todos los sitios de interacción intermolecular y los sitios de unión a la membrana inherentes a la poliproteína Gag. Por lo tanto, las moléculas de la poliproteína Gag-Pol se fusionan con la membrana y, junto con las moléculas de Gag, se incluyen en los viriones en formación, lo que resulta en la aparición de la proteasa activa y el inicio del proceso de maduración del virión. La proteasa del VIH-1 es altamente activa solo en forma de dímero; por lo tanto, para su autoexcisión de Prl60Gag-Pol, se requiere la dimerización de estas moléculas. La maduración del virión consiste en que la proteasa activa liberada corta prl60Gag-Pol y Gag55 en los sitios que reconoce; se forman las proteínas p17, p24, p7, p6, revertasa e integrasa, y se produce su asociación a la estructura viral.
La proteína Env se sintetiza en los ribosomas asociados a las membranas del retículo endoplasmático, luego es glicosilada, fragmentada por una proteasa celular en gp120 y gp41, y transportada a la superficie celular. En este caso, gp41 penetra la membrana y se une a los dominios de la matriz de la molécula de proteína Gag asociada a la superficie interna de la membrana. Esta conexión se conserva en el virión maduro.
Así, el ensamblaje de partículas virales consiste en la agregación de proteínas precursoras y moléculas de ARN asociadas en la membrana plasmática de la célula huésped, la formación de viriones inmaduros y su liberación por gemación desde la superficie celular. Durante la gemación, el virión se rodea de una membrana celular en la que se incrustan las moléculas gp41 y gp120. Durante la gemación o, posiblemente, después de la liberación de los viriones, se produce su maduración, que se lleva a cabo con la ayuda de una proteasa viral y consiste en el corte proteolítico de las proteínas precursoras Pr55Gag y Prl60Gag-Pol en proteínas del virus maduro y su asociación en ciertos complejos estructurales. El papel principal en los procesos de morfogénesis viral lo desempeña la poliproteína precursora Pr55Gag, que organiza y ensambla el virión inmaduro; el proceso de su maduración lo completa una proteasa viral específica.
Causas de la inmunodeficiencia
Una de las principales causas de inmunodeficiencia en la infección por VIH es la muerte masiva de células T cooperadoras. Esto ocurre como resultado de los siguientes eventos. Primero, las células T cooperadoras infectadas con el virus mueren por apoptosis. Se cree que en pacientes con sida, la replicación viral, la apoptosis y la disminución del número de células T cooperadoras están interconectadas. Segundo, las células T asesinas reconocen y destruyen las células T infectadas con el virus o que portan moléculas de gp120 adsorbidas, así como las células T cooperadoras infectadas y no infectadas por el virus, que forman simplastos (sincitios) compuestos por varias docenas de células (algunas de ellas mueren como resultado de la reproducción del virus en ellas). Como resultado de la destrucción de un gran número de células T cooperadoras, se produce una disminución en la expresión de receptores de membrana para la interleucina-2 en los linfocitos B. Se altera la síntesis de diversas interleucinas (factores de crecimiento y diferenciación de los linfocitos B: IL-4, IL-5, IL-6, etc.), lo que resulta en una alteración de la función del sistema de células T asesinas. Se suprime la actividad de los sistemas del complemento y macrófagos. Los macrófagos y monocitos infectados con el virus no mueren durante un tiempo prolongado, pero no son capaces de eliminarlo del organismo. Finalmente, debido a la similitud estructural y antigénica de la gp120 con los receptores de algunas células epiteliales del organismo (incluidos los receptores del trofoblasto que median la transmisión del VIH por trasplante), se sintetizan anticuerpos antirreceptor con un amplio espectro de acción. Estos anticuerpos pueden bloquear diversos receptores celulares y complicar la evolución de la enfermedad con trastornos autoinmunes. La consecuencia de la infección por VIH es la destrucción de todos los mecanismos principales del sistema inmunitario. Estos pacientes se vuelven indefensos frente a una amplia variedad de microorganismos. Esto conduce al desarrollo de infecciones oportunistas y tumores. En pacientes con VIH, el riesgo de desarrollar al menos tres tipos de cáncer aumenta: sarcoma de Kaposi; carcinoma (incluido el cáncer de piel); y linfoma de células B, que se produce debido a la transformación maligna de los linfocitos B. Sin embargo, el VIH no solo es linfocitotrópico, sino también neurotrópico. Penetra en las células del sistema nervioso central (astrocitos) tanto por endocitosis mediada por receptores como por fagocitosis de linfoblastos infectados por el virus por los astrocitos. Cuando el virus interactúa con los astrocitos, también se forman simplastos, que facilitan la propagación del patógeno a través de canales intercelulares. El virus puede persistir en macrófagos y monocitos durante mucho tiempo, por lo que actúan como reservorio y distribuidor en el organismo, pudiendo penetrar en todos los tejidos. Los macrófagos infectados desempeñan un papel fundamental en la introducción del VIH en el sistema nervioso central y su daño. En el 10 % de los pacientes, los síndromes clínicos primarios se asocian con daño al sistema nervioso central y se manifiestan como demencia. Por lo tanto, las personas infectadas por el VIH se caracterizan por tres grupos de enfermedades: infecciones oportunistas,enfermedades tumorales y daños al sistema nervioso central.
Epidemiología de la infección por VIH
La fuente de infección por VIH es únicamente una persona: una persona enferma o portadora del virus. El virus de la inmunodeficiencia humana (VIH) se encuentra en la sangre, el semen y el líquido cervical; en las madres lactantes, en la leche materna. La infección se produce por vía sexual, a través de la sangre y sus preparados, así como de madre a hijo antes, durante y después del parto. No se conocen casos de infección por alimentos, bebidas ni picaduras de insectos.
La drogadicción contribuye a la propagación del SIDA. La incidencia del VIH crece cada año. Según la OMS, entre 1980 y 2000, 58 millones de personas se infectaron con el VIH. Solo en el año 2000, 5,3 millones de personas se infectaron en todo el mundo y 3 millones murieron a causa del SIDA. El 1 de enero de 2004, se registraron en Rusia 264.000 personas infectadas con el VIH. La mitad de las personas infectadas con el VIH mueren en un plazo de 11 a 12 años desde el momento de la infección. A principios de 2004, de cada 100.000 ciudadanos rusos, aproximadamente 180 vivían con un diagnóstico de "infección por VIH". Se prevé que, con este nivel de morbilidad, el número total de personas infectadas por el VIH en Rusia para 2012 será de 2,5 a 3 millones de personas. La complejidad de la lucha contra la infección por el VIH depende de varias razones: en primer lugar, no existen métodos eficaces de tratamiento y prevención específicos; En segundo lugar, el período de incubación de la infección por VIH puede superar los 10 años. Su duración depende del momento de activación del linfocito T y del provirus de ADN contenido en su cromosoma. Aún no está claro si todas las personas infectadas con el virus están condenadas al SIDA o si es posible la portación a largo plazo del virus sin enfermedad (lo cual parece improbable). Finalmente, existen varios virus de inmunodeficiencia humana (VIH-1, VIH-2), cuyas diferencias antigénicas impiden la formación de inmunidad cruzada. El descubrimiento del virus de inmunodeficiencia en simios (VIS) arrojó luz sobre la cuestión del origen del VIH. El VIS es similar al VIH en su organización genómica, pero difiere significativamente en su secuencia de nucleótidos. El VIH-2 ocupa una posición intermedia entre el VIH-1 y el VIS en sus propiedades serológicas, y es más cercano al VIS en su secuencia de nucleótidos. En este sentido, V. M. Zhdanov sugirió que los virus VIH-1, VIH-2 y VIS se originaron a partir de un ancestro común. Es posible, según R. Gallo, que uno de los SIV haya entrado de alguna manera en el cuerpo humano, donde sufrió una serie de mutaciones, dando lugar a la aparición del VIH-1, el VIH-2 y sus otras formas.
Síntomas de la infección por VIH
El virus de la inmunodeficiencia humana (VIH) presenta características que determinan en gran medida la patogénesis de la enfermedad. El virus presenta una tasa de reproducción muy alta, determinada por sus elementos reguladores (se sintetizan hasta 5000 viriones en 5 minutos en la fase activa). Gracias a la presencia de la proteína de fusión (gp41), el virus induce la formación de extensas estructuras sincitiales mediante la fusión de células T colaboradoras infectadas y no infectadas, lo que provoca su muerte masiva. Las moléculas de proteína gp120, formadas en grandes cantidades, circulan libremente en la sangre y se unen a los receptores de las células T colaboradoras no infectadas, por lo que también son reconocidas y destruidas por las células T asesinas. El virus puede propagarse a través de canales intercelulares de célula a célula, en cuyo caso se vuelve difícilmente accesible para los anticuerpos.
Criterios clínicos de la infección por VIH
En adultos, la infección por VIH se diagnostica cuando presentan al menos dos síntomas graves en combinación con al menos un síntoma leve y en ausencia de otras causas conocidas de inmunodeficiencia (cáncer, inmunodeficiencia congénita, inanición grave, etc.). Los síntomas graves incluyen:
- pérdida de peso del 10% o más;
- un estado febril prolongado, intermitente o constante;
- diarrea crónica.
Síntomas menores: tos persistente, dermatitis generalizada, herpes zóster recurrente, candidiasis oral y faríngea, herpes simple crónico, linfadenopatía generalizada. El diagnóstico de SIDA se realiza únicamente ante la presencia de sarcoma de Kaposi, meningitis criptocócica y neumonía por Pneumocystis. El cuadro clínico de la enfermedad se ve influenciado por la infección oportunista concomitante.
Métodos de cultivo del virus de la inmunodeficiencia humana (VIH)
El VIH-1 y el VIH-2 pueden cultivarse en células de un solo clon de linfocitos TCV4 (H9), obtenido de linfocitos TCV4 leucémicos. Los cultivos en monocapa de astrocitos, en los que el VIH-1 se reproduce bien, también pueden utilizarse para estos fines. Los chimpancés son susceptibles al VIH-1 entre los animales.
La resistencia del virus al ambiente externo es baja. Muere bajo la influencia de la luz solar y la radiación UV, y se destruye a 80 °C en 30 minutos, y con desinfectantes comunes, en 20-30 minutos. Para desinfectar material con virus, es necesario utilizar desinfectantes micobactericidas, ya que son eficaces contra los microorganismos con mayor resistencia.
Diagnóstico de laboratorio de la infección por VIH
El principal método para diagnosticar la portación viral y la infección por VIH es el enzimoinmunoensayo. Sin embargo, debido a la similitud estructural y antigénica de la gpl20 con los receptores de algunas células humanas, incluyendo los receptores que transportan inmunoglobulinas a través de las células epiteliales de las membranas mucosas, pueden aparecer anticuerpos relacionados con la gpl20. En este caso, pueden producirse falsos positivos en las pruebas ELISA. Por lo tanto, todos los sueros de los sujetos que reaccionan positivamente se someten a un análisis adicional mediante inmunotransferencia o Western blot. Este método se basa en la identificación de los anticuerpos en estudio tras su separación electroforética y su posterior análisis con anticuerpos antiespecie marcados. El método virológico se utiliza con poca frecuencia debido a la complejidad del cultivo del virus. El clon de linfocito H9 se utiliza para obtener antígenos virales, componentes necesarios de los sistemas de diagnóstico. El método CPR permite detectar el virus en una etapa temprana de la viremia.
Tratamiento de la infección por VIH
Es necesario encontrar o sintetizar fármacos que supriman eficazmente la actividad de la transcriptasa inversa (revertasa) o la proteasa viral. Estos fármacos impedirían la formación del provirus de ADN y/o inhibirían la reproducción intracelular del virus. La estrategia moderna para el tratamiento de pacientes con VIH se basa en el principio del uso combinado de fármacos que inhiben la proteasa viral (uno de los fármacos) y la revertasa (dos fármacos diferentes): terapia combinada (triple). En Rusia, para el tratamiento de pacientes con VIH, se recomienda el uso combinado de dos fármacos nacionales: fosfazida y crixivan, que suprimen específicamente la reproducción del VIH en etapas tempranas y tardías de la reproducción, especialmente con una actividad reducida de la azidotimidina.
El problema de la profilaxis específica es la necesidad de crear una vacuna que garantice la formación de una inmunidad celular eficaz basada en linfocitos citotóxicos específicos del virus sin una producción significativa de anticuerpos. Dicha inmunidad es proporcionada por los cooperadores Thl. Es posible que los anticuerpos, incluidos los neutralizantes del virus, no solo sean ineficaces para suprimir la infección por VIH, sino que, en un nivel alto, supriman la inmunidad celular. Por lo tanto, una vacuna contra el VIH debe cumplir, en primer lugar, dos requisitos principales: a) ser absolutamente segura y b) estimular la actividad de los linfocitos T citotóxicos. Se está estudiando la eficacia de varias variantes de la vacuna obtenidas de virus muertos (inactivados) y de antígenos individuales con altas propiedades protectoras. Dichos antígenos pueden aislarse de los propios viriones o sintetizarse químicamente. Se ha propuesto una vacuna creada con base en métodos de ingeniería genética. Es un virus vaccinia recombinante que porta genes del VIH responsables de la síntesis de antígenos con fuertes propiedades inmunogénicas. La eficacia de estas vacunas requiere un tiempo considerable debido al largo periodo de incubación de la infección por VIH y a la alta variabilidad del patógeno. La creación de una vacuna altamente eficaz contra el VIH es un problema fundamental y urgente.

