Médico experto del artículo.
Nuevos artículos
Drogas
Neurolépticos o antipsicóticos
Último revisado: 04.07.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
Los antipsicóticos (neurolépticos) son una clase de fármacos psicotrópicos que se utilizan principalmente para tratar la esquizofrenia. Actualmente, se suelen distinguir dos grupos (o categorías) de fármacos: antipsicóticos típicos y atípicos. A continuación, se presenta información sobre las propiedades farmacológicas, las indicaciones de uso y los efectos secundarios del tratamiento de cada uno de estos grupos.
Indicaciones para el uso de antipsicóticos típicos
Actualmente, las principales indicaciones para la prescripción de neurolépticos tradicionales, según las recomendaciones proporcionadas por investigadores autorizados en el campo de la psicofarmacoterapia, incluyen las siguientes.
- Alivio de la agitación psicomotora y los trastornos del comportamiento causados por síntomas psicóticos graves. En estos casos, está indicado el uso de fármacos orales o parenterales con acción antipsicótica, tanto global (clopromazina, levomepromazina, tioproperazina, zuclopentixol) como selectiva, con efecto sobre los trastornos alucinatorios-paranoides (haloperidol, trifluoperazina).
- Terapia antirrecaída (preventiva). Para ello, se prescriben fármacos de liberación prolongada, especialmente en pacientes con baja adherencia al tratamiento (decanoato de haloperidol, flupentixol en su forma prolongada), o bien, en dosis bajas o medias, fármacos para obtener un efecto desinhibitorio (antinegativo), entre los que se utilizan dosis altas para aliviar trastornos psicóticos agudos (flupentixol, zuclopentixol). En este tipo de terapia, también se recomienda prescribir los llamados neurolépticos de liberación prolongada (tioridazina, clorprotixeno, sulpirida), cuya actividad psicotrópica consiste en un efecto sobre las manifestaciones del polo depresivo y los trastornos insomnes.
- Superar la resistencia terapéutica a los antipsicóticos atípicos en el tratamiento de estados psicóticos agudos. Para ello, se suelen utilizar formas parenterales de antipsicóticos tradicionales con acción antipsicótica global (clorpromazina, levomepromazina, etc.) y selectiva (haloperidol).
Estos fármacos causan diversos efectos secundarios, cuya naturaleza depende de las características de su perfil farmacológico. Los antipsicóticos con un efecto colinolítico más pronunciado suelen causar trastornos de la acomodación, estreñimiento, sequedad bucal y retención urinaria. El efecto sedante es más típico de los antipsicóticos con un efecto antihistamínico pronunciado, y la hipotensión ortostática es más típica de los fármacos que bloquean los receptores α1-adrenérgicos. El bloqueo de la transmisión colinérgica, nordrenérgica y dopaminérgica por parte de los neurolépticos típicos puede provocar diversos trastornos en la esfera sexual, como amenorrea o dismenorrea, anorgasmia, galactorrea, inflamación y dolor en las glándulas mamarias y disminución de la potencia sexual. Los efectos secundarios en la esfera sexual se asocian principalmente con las propiedades colinolíticas y adrenobloqueantes de estos fármacos, así como con un aumento de la secreción de prolactina debido al bloqueo del metabolismo de la dopamina. Los efectos secundarios más graves de los neurolépticos típicos son la disfunción motora. Son la causa más común de interrupción de la medicación. Los tres principales efectos secundarios de la terapia asociados con la influencia en la esfera motora incluyen síndromes extrapiramidales tempranos, discinesia tardía y síndrome neuroléptico maligno (SNM).
Se cree que los síndromes extrapiramidales se asocian con el bloqueo de los receptores D2 en los ganglios basales. Incluyen distonía, parkinsonismo neuroléptico y acatisia. Las manifestaciones de la reacción distónica aguda (discinesia temprana) incluyen hipercinesia de desarrollo repentino, crisis oculógiras, contracciones de los músculos de la cara y el tronco, y opistótonos. Estos trastornos dependen de la dosis y suelen presentarse tras 2-5 días de tratamiento con neurolépticos de alta potencia, como el haloperidol y la flufenazina. Para aliviar la discinesia temprana, se reduce la dosis del neuroléptico y se prescriben anticolinérgicos (biperideno, trihexifenidilo). La discinesia tardía suele afectar los músculos del cuello y, a diferencia de la reacción distónica aguda, responde menos al tratamiento con anticolinérgicos. El parkinsonismo neuroléptico se caracteriza por disminución de la motricidad espontánea, hipoamimia y amimia, temblor de reposo y rigidez. Es importante distinguir estos síntomas de los trastornos negativos aparentemente similares de la esquizofrenia, que se caracterizan por alienación emocional, entorpecimiento afectivo y anergia. Para corregir estos efectos secundarios, se indica el uso de anticolinérgicos, la reducción de la dosis del neuroléptico o su sustitución por un antipsicótico atípico. La acatisia se manifiesta por ansiedad interna, incapacidad para permanecer en un mismo lugar durante mucho tiempo y la necesidad de mover constantemente los brazos o las piernas. Para aliviarla, se utilizan anticolinérgicos y betabloqueantes centrales (propranolol).
La discinesia tardía se manifiesta por movimientos involuntarios de cualquier grupo muscular, con mayor frecuencia los músculos de la lengua y la boca. Clínicamente, se distinguen varias formas: discinesia de los músculos de las mejillas, la lengua y la boca (contracciones periódicas de los músculos masticatorios, que crean la impresión de una persona haciendo muecas; la lengua puede sobresalir involuntariamente de la boca del paciente); distonía tardía y acatisia tardía (el paciente realiza movimientos coreoatetósicos de la cabeza, el tronco y las extremidades superiores e inferiores). Este trastorno se registra principalmente durante el tratamiento a largo plazo con neurolépticos tradicionales y se detecta en aproximadamente el 15-20% de los pacientes que los toman como terapia de mantenimiento. Probablemente, en algunos pacientes el riesgo de desarrollar síntomas de discinesia aumenta, ya que algunos de ellos se observaron en la clínica de la esquizofrenia incluso antes de la era neuroléptica. Además, se ha descrito discinesia tardía en mujeres mayores y pacientes con trastornos afectivos. Se cree que la discinesia tardía se asocia con un aumento del número de receptores dopaminérgicos en el cuerpo estriado, aunque es probable que los sistemas GABAérgicos y otros neurotransmisores también participen en su patogénesis. No existe un tratamiento universal eficaz para estos efectos secundarios. Se sugiere que dosis bajas de neurolépticos de alta potencia con acción bloqueadora de la dopamina o vitamina E podrían tener un efecto beneficioso moderado en estos trastornos. La medida más eficaz para la discinesia tardía es reducir la dosis de un neuroléptico típico o sustituirlo por un antipsicótico atípico.
Según datos actuales, el síndrome neuroléptico maligno se presenta en aproximadamente el 0,5% de los casos de psicofarmacoterapia. Probablemente, la rara aparición de esta complicación potencialmente mortal se explique actualmente por la introducción generalizada de antipsicóticos atípicos, ya que el riesgo de desarrollar SNM durante el tratamiento con estos fármacos es insignificante. Se acepta generalmente que la principal causa del desarrollo del SNM es el bloqueo excesivo del sistema dopaminérgico durante la terapia con neurolépticos, especialmente tras aumentar la dosis de un antipsicótico de alta potencia. Los principales síntomas del SNM son hipertermia, aumento del tono muscular esquelético y de los reflejos tendinosos, y alteración de la consciencia con transición al coma. Los análisis de sangre revelan leucocitosis, aumento de la velocidad de sedimentación globular y de la actividad de las transaminasas hepáticas; los análisis de orina revelan albuminuria. Los trastornos del equilibrio hidroelectrolítico se producen rápidamente, lo que crea las condiciones para la formación de edema cerebral. El SNM es una afección aguda que requiere hospitalización urgente del paciente para recibir terapia intensiva de infusión. En el tratamiento del SNM, la hidratación y el tratamiento sintomático son fundamentales. En este caso, cualquier neuroléptico prescrito debe suspenderse de inmediato. En algunos casos, los agonistas de los receptores dopaminérgicos (por ejemplo, la bromocriptina) o los relajantes musculares tienen un efecto positivo, aunque su eficacia no se ha estudiado. Tras la suspensión del SNM, no se debe reanudar el tratamiento con el neuroléptico durante al menos dos semanas. Posteriormente, se puede prescribir un antipsicótico de baja potencia, preferiblemente un fármaco de nueva generación. La dosis del nuevo fármaco prescrito debe aumentarse con sumo cuidado, monitorizando el estado de las funciones vitales y los datos de laboratorio (análisis de sangre y orina).
Los neurolépticos típicos rara vez causan complicaciones mortales peligrosas. Las manifestaciones de sobredosis se relacionan principalmente con el perfil individual de la acción antiadrenérgica y anticolinérgica del fármaco. Dado que estos fármacos tienen un fuerte efecto antiemético, se indica el lavado gástrico para su eliminación, en lugar de la administración de eméticos. La hipotensión arterial, por regla general, es consecuencia del bloqueo de los receptores adrenérgicos y debe corregirse mediante la administración de dopamina y noradrenalina. En caso de arritmia cardíaca, está indicado el uso de lidocaína.
Mecanismo de acción y efectos farmacológicos de los antipsicóticos típicos
Con el desarrollo de la psicofarmacología, se propusieron diversas opciones para el efecto de los antipsicóticos sobre los neurorreceptores. La hipótesis principal sigue siendo que afectan a las neuroestructuras dopaminérgicas (principalmente los receptores D2), basándose en datos sobre la alteración del metabolismo normal de la dopamina en las estructuras cerebrales en las psicosis. Los receptores D2 dopaminérgicos se localizan en los ganglios basales, el núcleo accumbens y la corteza frontal; desempeñan un papel fundamental en la regulación del flujo de información entre la corteza cerebral y el tálamo.
La figura demuestra una comprensión más detallada de las alteraciones en la transmisión de dopamina en las áreas corticales y subcorticales del cerebro y el papel de estas alteraciones en el desarrollo de los síntomas de la esquizofrenia (adaptado de la monografía de Jones RB, Buckley PF, 2006).
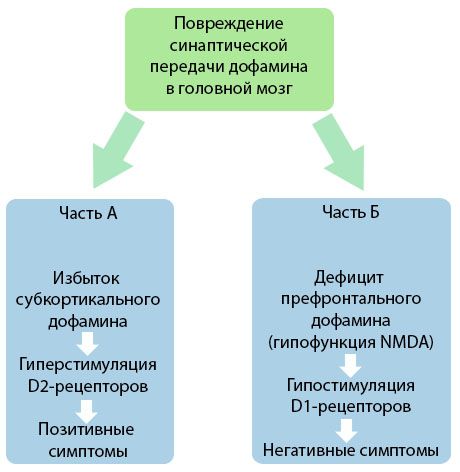
La Parte A refleja la teoría clásica temprana de la dopamina, que postula un exceso de dopamina en áreas subcorticales e hiperestimulación de los receptores D2, lo que conduce a la aparición de síntomas productivos. La Parte B demuestra la posterior modernización de la teoría a principios de la década de 1990. Los datos obtenidos para entonces revelaron que una deficiencia de dopamina en los receptores D, junto con una estimulación insuficiente de estos receptores en la corteza prefrontal, conduce a la aparición de síntomas negativos y déficits cognitivos. Por lo tanto, según la comprensión moderna, ambos tipos de trastornos de la transmisión dopaminérgica (un exceso de dopamina subcortical y su deficiencia en la corteza prefrontal) son el resultado combinado de una interrupción de la transmisión sináptica en el área prefrontal y están asociados con la hipofunción de N-metil-N-aspartato. Además de la dopamina, inicialmente aislada, se identificaron posteriormente otros neurotransmisores implicados en la patogénesis de la esquizofrenia, como la serotonina, el ácido gamma-aminobutírico, el glutamato, la noradrenalina, la acetilcolina y diversos neuropéptidos. Si bien el papel de estos mediadores no se ha estudiado a fondo, a medida que se avanza en el conocimiento, se hace evidente la manifestación de numerosos cambios neuroquímicos en el organismo. Por lo tanto, el efecto clínico de un fármaco antipsicótico es la suma de los efectos sobre diversas formaciones de receptores y conduce a la eliminación de los trastornos de la homeostasis.
En los últimos años, gracias a la aparición de nuevos métodos de investigación, como la unión de ligandos radioisotópicos y la tomografía por emisión de positrones (PET), se ha logrado un progreso significativo en el esclarecimiento del mecanismo de acción bioquímico de los neurolépticos. En particular, se ha determinado la fuerza y el tropismo comparativos de los fármacos para unirse a neurorreceptores individuales en diversas áreas y estructuras cerebrales. Se ha demostrado una dependencia directa de la gravedad del efecto antipsicótico de un fármaco con la intensidad de su efecto bloqueador sobre diversos receptores dopaminérgicos. Recientemente, se han identificado cuatro tipos de estos receptores:
- Las D1 se localizan predominantemente en la zona de la sustancia negra y del cuerpo estriado (la llamada región nigroestriatal), así como en la región prefrontal;
- D2 - en las regiones nigroestriatal, mesolímbica y en la glándula pituitaria anterior (secreción de prolactina);
- D3 (presináptica) - en varias estructuras cerebrales, controla la actividad dopaminérgica según la ley de retroalimentación negativa;
- D4 (presináptico): predominantemente en las áreas nigroestriatal y mesolímbica.
Al mismo tiempo, se ha comprobado que el bloqueo de los receptores D2 provoca el desarrollo de efectos antipsicóticos, sedantes secundarios y efectos secundarios extrapiramidales. Otras manifestaciones clínicas del bloqueo de este tipo de receptores son el efecto analgésico y antiemético de los neurolépticos (reducción de las náuseas y vómitos como resultado de la supresión del centro del vómito), así como una disminución del contenido de hormona del crecimiento y un aumento de la producción de prolactina (efectos secundarios neuroendocrinos, como galactorrea e irregularidades menstruales). El bloqueo prolongado de los receptores D2 nigroestriatales provoca la aparición de su hipersensibilidad, responsable del desarrollo de discinesias tardías y psicosis por hipersensibilidad. Las probables manifestaciones clínicas del bloqueo de los receptores presinápticos D3 y D4 se asocian principalmente con el efecto estimulante de los neurolépticos. Debido al bloqueo parcial de estos receptores en las áreas nigroestriatal y mesolimbocortical, los neurolépticos activadores e incisivos (potentes, altamente activos) en pequeñas dosis pueden estimular, y en dosis altas suprimir, la transmisión dopaminérgica.
En los últimos años, el interés en la función de los sistemas serotoninérgicos del cerebro, incluyendo los receptores de serotonina, ha aumentado considerablemente. De hecho, en diversas partes del cerebro, el sistema serotoninérgico tiene un efecto modulador sobre las estructuras dopaminérgicas. En particular, en la región mesocortical, la serotonina inhibe la liberación de dopamina y, en consecuencia, el bloqueo de los receptores postsinápticos 5-HT conduce a un aumento en el contenido de dopamina. Como es sabido, el desarrollo de síntomas negativos en la esquizofrenia se asocia con la hipofunción de las neuronas dopaminérgicas en las estructuras prefrontales de la corteza cerebral. Actualmente, se conocen alrededor de 15 tipos de receptores centrales 5-HT. Se ha descubierto experimentalmente que los neurolépticos se unen principalmente a los receptores 5-HT de los tres primeros tipos.
Estos fármacos tienen un efecto principalmente estimulante (agonista) sobre los receptores 5-HT1a. Posibles consecuencias clínicas: aumento de la actividad antipsicótica, disminución de la gravedad de los trastornos cognitivos, corrección de los síntomas negativos, efecto antidepresivo y disminución de la incidencia de efectos secundarios extrapiramidales.
El efecto de los neurolépticos sobre los receptores 5-HT2, especialmente sobre los subtipos 5-HT2a, es crucial. Estos se localizan principalmente en la corteza cerebral y su sensibilidad aumenta en pacientes con esquizofrenia. La capacidad de los neurolépticos de nueva generación para reducir la gravedad de los síntomas negativos, mejorar las funciones cognitivas, regular el sueño al aumentar la duración total de las fases de sueño de ondas lentas (ondas D), reducir la agresividad y aliviar los síntomas depresivos y las cefaleas migrañosas (derivadas de trastornos cerebrovasculares) se asocia con el bloqueo de los receptores 5-HT2a. Por otro lado, el bloqueo de los receptores 5-HT2a puede provocar efectos hipotensores y trastornos de la eyaculación en hombres.
Se cree que el efecto de los neurolépticos sobre los receptores 5-HT2c provoca un efecto sedante (ansiolítico), aumento del apetito (acompañado de un aumento del peso corporal) y una disminución de la producción de prolactina.
Los receptores 5-HT3 se localizan predominantemente en la región límbica y cuando se bloquean se desarrolla primero el efecto antiemético, y también se potencian los efectos antipsicóticos y ansiolíticos.
La aparición de síntomas parkinsonianos también depende del poder bloqueante del fármaco sobre los receptores colinérgicos muscarínicos. Los efectos colinolíticos y dopaminérgicos se encuentran, hasta cierto punto, en relaciones recíprocas. Se sabe, por ejemplo, que en la región nigroestriatal, los receptores D2 inhiben la liberación de acetilcolina. Cuando más del 75% de los receptores D2 en la región nigroestriatal están bloqueados, el equilibrio se altera a favor del sistema colinérgico. Esta es la razón del efecto corrector de los fármacos anticolinérgicos (correctores) sobre los efectos secundarios extrapiramidales de los neurolépticos. El clorprotixeno, la clozapina y la olanzapina tienen una alta afinidad por los receptores muscarínicos y prácticamente no causan efectos secundarios extrapiramidales, ya que bloquean simultáneamente los receptores colinérgicos y dopaminérgicos. El haloperidol y los derivados de la piperazina fenotiazina tienen un efecto pronunciado sobre los receptores dopaminérgicos, pero un efecto muy débil sobre los receptores de colina. Esto se debe a su capacidad de causar pronunciados efectos secundarios extrapiramidales, que se reducen cuando se usan dosis muy altas, cuando el efecto colinolítico se hace notable. Además de reducir el efecto bloqueador de la dopamina sobre los receptores D2 de la región nigroestriatal y nivelar los efectos secundarios extrapiramidales, un fuerte efecto colinérgico puede causar deterioro de las funciones cognitivas, incluyendo trastornos de la memoria, así como efectos secundarios periféricos (membranas mucosas secas, alteración de la acomodación visual, estreñimiento, retención urinaria, confusión, etc.). Los neurolépticos tienen un efecto bloqueador bastante fuerte sobre los receptores de histamina tipo I, que se asocia, en primer lugar, con la gravedad del efecto sedante, así como con un aumento del peso corporal debido al aumento del apetito. Los efectos antialérgicos y antipruriginosos de los neurolépticos también están asociados con sus propiedades antihistamínicas.
Además de sus efectos bloqueadores de la dopamina, antiserotoninérgicos, colinolíticos y antihistamínicos, la mayoría de los neurolépticos poseen propiedades adrenolíticas, es decir, bloquean los receptores α1-adrenérgicos tanto centrales como periféricos. Los adrenobloqueantes, como la clorpromazina y el clorprotixeno, tienen un marcado efecto sedante. Además, el efecto bloqueante de estos fármacos puede causar efectos secundarios neurovegetativos (hipotensión arterial, taquicardia, etc.), así como un aumento del efecto hipotensor de los adrenobloqueantes.
Los trabajos de un gran número de autores proporcionan datos sobre la fuerza de unión (afinidad) de los neurolépticos individuales con diferentes tipos de neurorreceptores.
En función de su perfil de acción neuroquímico, los antipsicóticos típicos y atípicos, entre los predominantemente utilizados en la práctica clínica, pueden dividirse condicionalmente en seis grupos.
El primer grupo está compuesto por bloqueadores selectivos de los receptores D2 y D4 (sulpirida, amisudprida, haloperidol, etc.) de los grupos de derivados de benzamida y butirofenona. En pequeñas dosis, debido principalmente al bloqueo de los receptores D4 presinápticos, activan la transmisión dopaminérgica de los impulsos nerviosos y tienen un efecto estimulante (desinhibitorio). En dosis altas, bloquean los receptores D2 en todas las áreas cerebrales, lo que se manifiesta clínicamente con un marcado efecto antipsicótico, así como con efectos secundarios extrapiramidales y endocrinos (debido a la prolactinemia).
El segundo grupo incluye bloqueadores de los receptores D2 altamente activos, así como fármacos que bloquean débil o moderadamente los receptores 5-HT2a y 5-HT1a (flupentixol, flufenazina, zuclopentixol, etc.), es decir, principalmente derivados piperazínicos de fenotiazinas o tioxantenos con una estructura estereoquímica similar a la de estos. Al igual que los fármacos del primer grupo, estos neurolépticos presentan, en primer lugar, un pronunciado efecto antipsicótico (incisivo), además de causar efectos extrapiramidales y prolactinemia. En dosis bajas, tienen un efecto moderadamente activador (psicoestimulante).
El tercer grupo consiste en neurolépticos sedantes polivalentes que bloquean la mayoría de los neurorreceptores de forma indiferenciada. Estos fármacos tienen un efecto bloqueante claramente expresado sobre los receptores dopaminérgicos y también causan fuertes efectos adrenolíticos y colinolíticos. Esto incluye la mayoría de los neurolépticos sedantes, principalmente los derivados alifáticos y piperidínicos de la fenotiazina, así como los tioxantenos con una estructura estereoquímica similar (clorpromazina, levomepromazina, clorprotixeno, etc.). El espectro de actividad psicotrópica de estos fármacos está dominado, en primer lugar, por un pronunciado efecto sedante primario, que se desarrolla independientemente de la dosis utilizada, y un efecto antipsicótico moderado. Además, debido a su pronunciado efecto anticolinérgico, los fármacos de este grupo causan efectos secundarios extrapiramidales y neuroendocrinos leves o moderados, pero a menudo conducen al desarrollo de hipotensión ortostática y otras reacciones autonómicas debido al bloqueo pronunciado de los receptores adrenérgicos α1.
El cuarto grupo incluye neurolépticos que bloquean los receptores D2 y 5-HT2a de manera equilibrada, es decir, en la misma medida (este último en una medida ligeramente mayor) y los a1-adrenorreceptores en una medida moderada. Este grupo incluye representantes de la nueva generación de antipsicóticos atípicos (risperidona, ziprasidona, sertindol), que tienen diferentes estructuras químicas. El mecanismo de acción neuroquímico determina su influencia selectiva principalmente en las áreas mesolímbicas y mesocorticales del cerebro. Junto con un efecto antipsicótico distintivo, la ausencia o expresión débil de efectos secundarios extrapiramidales (cuando se utilizan dosis terapéuticas), prolactinemia débil o moderada y propiedades adrenolíticas moderadas (reacciones hipotensoras), este grupo de neurolépticos es capaz de corregir los síntomas negativos mediante la estimulación indirecta de la transmisión dopaminérgica en la corteza cerebral.
El quinto grupo está compuesto por antipsicóticos atípicos polivalentes de dibenzodiazepina tricíclica o de estructura similar (clozapina, olanzapina y quetiapina). Al igual que los fármacos del tercer grupo, bloquean la mayoría de los neurorreceptores de forma indiferenciada. Sin embargo, los receptores 5-HT2a se bloquean con mayor intensidad que los receptores D2 y D4, especialmente los localizados en la región nigroestriatal. Esto determina la ausencia o el escaso efecto extrapiramidal, así como la ausencia de efectos secundarios neuroendocrinos asociados con el aumento de la producción de prolactina, con un marcado efecto antipsicótico y la capacidad de reducir la gravedad de los síntomas negativos. Además, todos los fármacos de este grupo poseen marcadas propiedades adrenolíticas y antihistamínicas, lo que determina sus efectos sedantes e hipotensores. La clozapina y la olanzapina también tienen un efecto bloqueante bastante pronunciado sobre los receptores muscarínicos y conducen al desarrollo de efectos secundarios colinolíticos.
Por tanto, la capacidad de bloquear los receptores dopaminérgicos postsinápticos con un aumento compensatorio de la síntesis y el metabolismo de la dopamina es la única propiedad bioquímica común de todos los neurolépticos considerados en estos grupos.
El sexto grupo incluye el único antipsicótico atípico, el aripiprazol, de reciente aparición en el mercado nacional de psicofarmacología. Este fármaco es un agonista parcial de los receptores dopaminérgicos D2 y actúa como antagonista funcional en estados hiperdopaminérgicos y como agonista funcional en estados hipodopaminérgicos. Este perfil receptor único del aripiprazol permite reducir el riesgo de trastornos extrapiramidales e hiperprolactinemia. Además, el aripiprazol actúa como agonista parcial de los receptores 5-HT1a y, al mismo tiempo, como antagonista de los receptores 5-HT2a. Se supone que esta interacción con los receptores conduce a un funcionamiento equilibrado de los sistemas serotoninérgico y dopaminérgico, por lo que el mecanismo de acción del aripiprazol puede definirse como la estabilización del sistema dopaminérgico-serotoninérgico.
Por lo tanto, el nivel actual de conocimiento sobre los mecanismos de acción neuroquímicos de los neurolépticos nos permite proponer una nueva clasificación farmacodinámica, patogénicamente más fundamentada, de este grupo de psicofármacos. El uso de esta clasificación nos permite predecir en gran medida el espectro de actividad psicotrópica, la tolerancia y las probables interacciones farmacológicas de un fármaco en particular. En otras palabras, las características de la actividad neuroquímica de un fármaco determinan en gran medida las características de su actividad clínica, lo cual debe tenerse en cuenta al elegir un antipsicótico específico para un paciente específico.
La eficacia del efecto antipsicótico global de cualquier neuroléptico se estima mediante el equivalente de clorpromazina, que se considera 1. Por ejemplo, el equivalente de clorpromazina del haloperidol es 50. Esto significa que la eficacia antipsicótica de 1 mg de haloperidol es comparable a la de 50 mg de clorpromazina. Con base en este indicador, se ha desarrollado una clasificación que permite la asignación de neurolépticos con actividad antipsicótica alta (equivalente de clorpromazina > 10,0), media (equivalente de clorpromazina = 1,0-10,0) y baja (equivalente de clorpromazina = 1,0), denominada patente. Los neurolépticos típicos (antipsicóticos de primera generación) se han utilizado ampliamente en la psicofarmacoterapia clínica durante casi medio siglo. El espectro de su actividad terapéutica incluye:
- Acción antipsicótica global en forma de capacidad para reducir de manera uniforme y diferencial diversas manifestaciones de la psicosis:
- efecto sedante (inhibidor) primario: la capacidad de los medicamentos para aliviar rápidamente la agitación psicomotora;
- acción antipsicótica selectiva, que se manifiesta en la capacidad de influir en los síntomas individuales: delirio, alucinaciones, desinhibición de las pulsiones, etc.;
- acción neurotrópica activadora (desinhibitoria, desinhibitoria, antiautista), que se manifiesta por el desarrollo de síntomas extrapiramidales;
- acción somatotrópica en forma de desarrollo de efectos secundarios neuroendocrinos y vegetativos;
- efecto depresor, expresado en la capacidad de algunos antipsicóticos de causar síntomas depresivos.
La eficacia de los antipsicóticos de primera generación en el tratamiento no solo de los trastornos psicóticos, sino también de los trastornos limítrofes, ha sido demostrada en numerosas ocasiones y es indiscutible. Por lo tanto, a pesar de la alta frecuencia de efectos secundarios de la terapia cuando se prescriben, se siguen utilizando en la práctica médica.
Antipsicóticos atípicos
Las guías modernas contienen datos sobre las ventajas del uso de antipsicóticos de segunda generación en la farmacoterapia. El término "atípico" (sinónimo: antipsicóticos de segunda generación) es condicional y se utiliza principalmente para designar a la nueva generación. En comparación con los neurolépticos tradicionales, los fármacos de este grupo son más eficaces para corregir trastornos negativos, afectivos y cognitivos, lo que se combina con una mejor tolerabilidad y un menor riesgo de síntomas extrapiramidales. Las diferencias en la naturaleza del efecto terapéutico de un fármaco de la serie de antipsicóticos atípicos se explican, al igual que en el grupo de los neurolépticos típicos, por su perfil de acción farmacológica individual.
Para aclarar las posibilidades de la psicofarmacoterapia con antipsicóticos atípicos, es aconsejable centrarse en los medicamentos de este grupo registrados en Rusia.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Clozapina (dibenzodiazepina)
Fundador del grupo de antipsicóticos atípicos. El mecanismo de acción de la clozapina se caracteriza por un ligero bloqueo de los receptores D2 con un alto antagonismo simultáneo con los receptores 5-HT2a, α1, α2-adrenérgicos y H1-histamina. Ha demostrado ser un antipsicótico eficaz en casos de resistencia a otros antipsicóticos (un fármaco del grupo de reserva) y también está indicado para el tratamiento de la manía crónica, la agitación psicótica y la agresividad. En la práctica clínica, la clozapina se prescribe a menudo para lograr sedación y como hipnótico en pacientes psicóticos. Cabe destacar que este uso de la clozapina no se corresponde con sus principales indicaciones terapéuticas. Probablemente, se deba revisar la perspectiva de este antipsicótico como fármaco secundario, ya que actualmente es el único fármaco con eficacia demostrada en pacientes resistentes.
La clozapina, a diferencia de los neurolépticos habituales, no causa trastornos extrapiramidales graves debido a la ya mencionada baja afinidad por los receptores de O₂. También se ha demostrado que puede utilizarse para tratar la distonía tardía y la acatisia grave. Debido al bajo riesgo de desarrollar SNM, la clozapina puede considerarse un fármaco de elección en pacientes que han padecido previamente esta complicación.
Sin embargo, durante el tratamiento con clozapina pueden presentarse diversos efectos secundarios graves. El más peligroso (incluso con dosis bajas) es la agranulocitosis, que se presenta en el 0,5-1,0 % de los pacientes. Otros efectos secundarios importantes que pueden presentarse al usar el fármaco incluyen somnolencia, hipersalivación y aumento de peso, que a menudo ya es elevado al momento de prescribir clozapina, bajo la influencia de un tratamiento antipsicótico previo. También se debe tener en cuenta la posibilidad de desarrollar taquicardia, hipotensión arterial y convulsiones epilépticas al tomarlo. La probabilidad de convulsiones depende de la dosis. El riesgo aumenta significativamente si la dosis de clozapina supera los 600 mg/día. El desarrollo de convulsiones no constituye una contraindicación para el uso posterior del fármaco, pero requiere reducir la dosis a la mitad y prescribir anticonvulsivos, como el ácido valproico. La prevención de los efectos secundarios del tratamiento con clozapina incluye una monitorización cuidadosa del recuento de glóbulos blancos, así como del ECG y de los parámetros endocrinos.
La sobredosis de clozapina puede causar depresión del estado de consciencia, incluso coma, así como síntomas asociados al efecto colinolítico (taquicardia, delirio), convulsiones epilépticas, depresión respiratoria y síndromes extrapiramidales. Una dosis superior a 2500 mg del fármaco puede ser mortal.
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
Risperidona
Un derivado del benzisoxazol con alta afinidad por los receptores de serotonina y dopamina Dj, con un efecto predominante sobre el sistema serotoninérgico. Este fármaco tiene una amplia gama de indicaciones, incluyendo el alivio de las exacerbaciones, el tratamiento antirrecaídas, el tratamiento del primer episodio psicótico y la corrección de los síntomas negativos de la esquizofrenia. Se ha demostrado que mejora la función cognitiva en pacientes con esquizofrenia. Se han obtenido datos preliminares que indican que la risperidona también reduce los síntomas afectivos comórbidos en pacientes con esquizofrenia y podría ser un fármaco de elección en el tratamiento del trastorno afectivo bipolar.
Los efectos secundarios del tratamiento con risperidona, especialmente los trastornos extrapiramidales, dependen de la dosis y son más frecuentes con dosis superiores a 6 mg/día. Otros efectos secundarios incluyen náuseas, vómitos, ansiedad, somnolencia y aumento de los niveles séricos de prolactina. El uso prolongado de risperidona puede provocar aumento de peso y diabetes mellitus tipo 2, pero con menor probabilidad que con clozapina y olanzapina.
La sobredosis puede causar somnolencia, convulsiones epilépticas, prolongación del intervalo QT y ensanchamiento del complejo QRS, e hipotensión arterial. Se han descrito casos de desenlace fatal por sobredosis de risperidona.
La ventaja indudable del fármaco reside en su disponibilidad en presentaciones líquidas y de rápida disolución (sublinguales), lo que acelera su absorción y facilita el control de su administración. También existe una presentación prolongada: polvo para la preparación de una suspensión intramuscular (consta-risperidona en microesferas). Se recomienda para el tratamiento de mantenimiento en pacientes con esquizofrenia, especialmente en aquellos con baja adherencia al tratamiento. Es importante tener en cuenta que el fármaco tarda aproximadamente tres semanas en penetrar en la sangre; por lo tanto, al iniciar el tratamiento con consta-risperidona, el paciente debe tomar adicionalmente la presentación oral de risperidona durante al menos tres semanas después de la primera inyección.
Olanzapina
En términos de acción farmacológica, es similar a la clozapina, ya que presenta un perfil de receptores pleiomórficos con afinidad significativa por los receptores serotoninérgicos, muscarínicos, α1-adrenérgicos e histamínicos. La actividad terapéutica de la olanzapina presenta características similares a la de la clozapina y la risperidona en cuanto a su impacto sobre los síntomas positivos, negativos y depresivos de la esquizofrenia. Asimismo, se han obtenido datos sobre la mayor eficacia de la olanzapina en comparación con otros antipsicóticos atípicos en pacientes con un primer episodio psicótico y en la corrección de los indicadores de funcionamiento cognitivo. Debe tenerse en cuenta que al inicio del tratamiento con comprimidos, puede aparecer un rápido efecto desinhibitorio con aumento de la agitación psicomotora y la ansiedad. Por lo tanto, en el tratamiento de crisis con agitación psicomotora grave, está indicado el uso de la forma inyectable.
La olanzapina rara vez causa trastornos extrapiramidales o discinesia tardía, y los efectos secundarios más comunes son trastornos metabólicos y aumento de peso. Se ha establecido que los pacientes que reciben olanzapina suelen experimentar niveles elevados de colesterol y lípidos plasmáticos, así como una predisposición a la diabetes mellitus tipo 2; sin embargo, estos efectos fueron igualmente comunes en pacientes que recibieron tanto olanzapina como clozapina. Al mismo tiempo, se han obtenido datos que muestran que el aumento de peso se correlaciona con una respuesta positiva a la olanzapina (es decir, sirve como un importante indicador pronóstico del tratamiento) y que solo se desarrolla obesidad en el 20-30 % de los pacientes que han aumentado de peso durante el tratamiento.
La sobredosis puede causar sedación, efectos anticolinérgicos tóxicos, convulsiones epilépticas e hipotensión arterial. Actualmente no existen datos concluyentes que evalúen el riesgo de muerte por sobredosis.
Quetiapina
Se clasifica como un compuesto dibenzotiazepínico. Su perfil receptor es en gran medida similar al de la clozapina. La unión de la quetiapina a los receptores D2 es baja (inferior al 50%) y de corta duración, incluso en dosis altas. El fármaco es eficaz en el tratamiento de los síntomas positivos, negativos y generales de la esquizofrenia. Existe evidencia de su uso exitoso tanto en casos de alta resistencia al tratamiento como para la mejora del funcionamiento cognitivo de los pacientes, lo que justifica su recomendación como antipsicótico de primera línea para el tratamiento de mantenimiento de la esquizofrenia. Finalmente, la quetiapina posee un efecto antidepresivo activador moderado. Por lo tanto, está indicada en el tratamiento de crisis depresivas-delirantes y trastornos del círculo senesto-hipocondríaco.
La alta actividad timotrópica demostrada de la quetiapina explica su registro como fármaco para el alivio y la prevención secundaria de los trastornos depresivos. Para el tratamiento de los episodios maníacos en los trastornos bipolares de tipo I y II, la quetiapina se utiliza como fármaco adicional. La ausencia de presentaciones inyectables limita en cierta medida su uso en pacientes con agitación y comportamiento agresivo.
La quetiapina es bien tolerada y prácticamente no causa síndromes extrapiramidales, excepto en casos en que se utilizan dosis máximas. No causa hiperprolactinemia; con menos frecuencia que la olanzapina y la clozapina, pero sí provoca aumento de peso y alteración de la tolerancia a la glucosa.
Ziprasidona
Tiene un perfil único de actividad receptora. Al ser un potente antagonista de los receptores 5HT2a y D2, también es un inhibidor activo de la recaptación de serotonina y noradrenalina. Estudios clínicos han demostrado una superioridad significativa de la ziprasidona en su efecto sobre los síntomas psicóticos y las manifestaciones de agresión en comparación con el haloperidol. También existen datos sobre el efecto positivo de la ziprasidona en las funciones cognitivas de pacientes con esquizofrenia, así como en los síntomas afectivos comórbidos, indicadores del funcionamiento social. La ziprasidona suele ser bien tolerada y rara vez causa síndromes extrapiramidales, aumento de peso y trastornos metabólicos. Con mayor frecuencia, se observa una prolongación del intervalo QT superior a 460 ms; por lo tanto, se recomienda que los pacientes que reciben este fármaco se sometan a un ECG antes de prescribirlo y a un seguimiento durante el tratamiento. Se debe prestar especial atención al tratamiento concomitante (toma de fármacos antiarrítmicos), que puede agravar la prolongación del intervalo QT y provocar el desarrollo de arritmias cardíacas y fibrilación ventricular.
Sertindol
Pertenece a los derivados del fenilindol. Presenta un alto antagonismo funcional con respecto a los receptores D2, serotoninérgicos (especialmente los receptores 5-HT2a) y adrenérgicos α1. Según estudios electroneuroquímicos, el sertindol inhibe selectivamente los receptores dopaminérgicos en la región segmentaria ventral. Esta selectividad, con toda probabilidad, garantiza un bajo riesgo de síndromes extrapiramidales e hiperprolactinemia al usar el fármaco. Los resultados de estudios comparativos han demostrado que el sertindol es comparable al haloperidol en términos de actividad antipsicótica. El fármaco tiene un pronunciado efecto desinhibitorio en pacientes con síntomas negativos y depresivos, superior al efecto similar del rispolept. También existe evidencia que confirma la eficacia del sertindol para la corrección del deterioro cognitivo en pacientes con esquizofrenia. El sertindol generalmente es bien tolerado por los pacientes, rara vez causa sedación y, por lo tanto, se recomienda como fármaco de reemplazo cuando se presentan efectos secundarios durante el tratamiento con otros antipsicóticos modernos.
Entre los efectos secundarios graves se incluye la capacidad del fármaco para prolongar el intervalo QT, lo que puede provocar arritmias cardíacas. Al analizar los estudios poscomercialización, se observó que el perfil cardíaco del sertindol no difiere del de otros antipsicóticos de nueva generación.
Aripiprazol
Tiene una actividad antipsicótica comparable a la de otros fármacos atípicos, pero tiene un mayor efecto sobre el funcionamiento cognitivo de los pacientes con esquizofrenia. Su acción farmacológica única, ya mencionada (un agonista parcial de los receptores D2), permite reducir el riesgo de síndromes extrapiramidales e hiperprolactinemia.
 [ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
[ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
Amisulprida
Pertenece a la clase de las benzamidas sustituidas. El fármaco se une selectivamente a los subtipos de receptores dopaminérgicos D2 y D3, sin afinidad por los subtipos D1, D4 y D5, ni por los receptores serotoninérgicos, H1-histamínicos, α1-adrenérgicos y colinérgicos. En dosis altas, bloquea los receptores D2 postsinápticos. En dosis bajas, su efecto desinhibitorio se manifiesta mediante el bloqueo de los receptores presinápticos D2 y D3, por lo que también es eficaz en el tratamiento de síntomas negativos, aunque no es un antagonista combinado de los receptores D2 y serotoninérgicos. Diversos estudios indican una marcada actividad antipsicótica del fármaco en dosis altas, superior a la de los fármacos tradicionales.
 [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
[ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
Efectos secundarios de la terapia antipsicótica
La tabla enumera los principales efectos secundarios de la terapia antipsicótica atípica.
Preparación |
|
Alteración de la conducción en el ECG |
Trastornos metabólicos (aumento de peso, aumento de los niveles de glucosa, colesterol, triglicéridos en la sangre) |
||
Clozapina |
. |
++ |
++ |
++- |
|
Risperidona |
++ |
+/- |
++ |
+/- |
|
Olanzapina |
+ |
+/- |
+++ |
++ |
+++ |
Quetiapina |
+/- |
+ |
+/- |
--- |
|
Ziprasidona |
+ |
++ |
+/- |
+/- |
+/- |
Sertindol |
++ |
-- |
+/- |
-- |
|
Ariliprazol |
-- |
--- |
+/- |
-- |
-- |
Amisulprida |
++ |
+/- |
|||
Nota. Gravedad de los efectos secundarios: "+++" - alta; "++" - media; "+" - baja; "+/-" - cuestionable; "-" - ausente.
Síndromes extrapiramidales
Una de las principales características de los antipsicóticos atípicos, a diferencia de los tradicionales, es su baja capacidad para causar síndromes extrapiramidales, lo que supuso un gran avance en la farmacoterapia de mantenimiento de la esquizofrenia. Sin embargo, como se desprende de los datos de la tabla, al utilizar fármacos individuales de esta serie (risperidona, amisulprida), pueden presentarse estos síntomas, lo que requiere especial atención al prescribirlos.
 [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Anormalidades del ECG
La posibilidad de desarrollar efectos secundarios cardíacos es un problema grave al utilizar algunos antipsicóticos modernos en terapia. En estos casos, se trata de la prolongación del intervalo QT, que puede provocar arritmias. Las alteraciones de la conducción, principalmente la prolongación del intervalo QT, se observan con mayor frecuencia durante el tratamiento con clozapina, sertindol y ziprasidona. La presencia de patología concomitante, como bradicardia, bloqueo auriculoventricular e hipotiroidismo, puede contribuir a la aparición de esta complicación durante el tratamiento con los fármacos mencionados. Actualmente, se recomienda la monitorización electrocardiográfica aproximadamente una vez cada 3 meses en pacientes que reciben terapia de mantenimiento con antipsicóticos atípicos.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
Trastornos endocrinos
Actualmente, la mayor preocupación es causada por la capacidad de los fármacos antipsicóticos atípicos para causar aumento de peso. El aumento del peso corporal, la glucosa y los niveles de triglicéridos en la sangre pueden conducir a trastornos metabólicos y al desarrollo de diabetes tipo 2. Se requiere precaución particular y monitoreo semanal de los parámetros bioquímicos durante la terapia con clozapina y olanzapina. Según J. Geddes et al. (2000), PB Jones, PF Buckley (2006), debe reconocerse como apropiado realizar un examen exhaustivo de los pacientes antes de prescribirles un antipsicótico particular de la generación moderna, ya que se sabe que los trastornos metabólicos ocurren con mayor frecuencia en pacientes que tenían una predisposición hereditaria, exceso de peso corporal, trastornos del espectro lipídico e hiperglucemia antes del inicio del tratamiento. El algoritmo de monitoreo propuesto por PB Jones, PF Buckley (2006) incluye varios puntos.
- Recopilación de la historia clínica y de factores familiares relacionados con el riesgo de trastornos metabólicos.
- Registro del índice de masa corporal, ECG, presión arterial y pulso antes del inicio del tratamiento.
- Recopilación de datos de laboratorio (glucosa, perfil lipídico, colesterol) antes de iniciar la terapia.
- Monitorización regular del índice de masa corporal y de los signos vitales durante el tratamiento.
- Monitoreo de datos de laboratorio durante el tratamiento.
La aparición de hiperprolactinemia durante el tratamiento antipsicótico se debe al bloqueo central de los receptores dopaminérgicos en el hipotálamo, lo que provoca la liberación de prolactina de la hipófisis anterior. La hiperprolactinemia se presenta con mayor frecuencia durante el tratamiento con olanzapina, risperidona y amisulprida.
 [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
Agranulocitosis
Otra complicación grave de la terapia antipsicótica. Se puede observar durante el tratamiento con clozapina y olanzapina. Según J. Geddes et al. (2000), se diagnosticó durante los primeros 3 meses en el 1-2% de los pacientes que tomaban estos fármacos. En este sentido, se recomiendan análisis de sangre semanales para los pacientes que toman estos fármacos durante las primeras 18 semanas de terapia y un seguimiento mensual a partir de entonces. Se ha demostrado que cuando se reduce la dosis de los neurolépticos mencionados, el análisis de sangre clínico se normaliza. Al mismo tiempo, debe reconocerse que hasta la fecha no existe una estrategia clara para los pacientes que experimentan los efectos secundarios mencionados anteriormente asociados con trastornos metabólicos. Con mayor frecuencia, un antipsicótico atípico se reemplaza por otro. Otra dirección prometedora es el nombramiento de una terapia correctiva especial, en particular el uso de bromocriptina para corregir la hiperprolactinemia. La situación ideal es aquella en la que el cuidado de un paciente con tales trastornos se lleva a cabo con la participación periódica de internistas, en particular endocrinólogos, cardiólogos y otros especialistas.
En conclusión, cabe señalar que si se siguen los algoritmos dados para prescribir y controlar no sólo el estado mental sino también el físico de los pacientes, el uso de medicamentos de segunda generación es más seguro que los neurolépticos típicos.
Actualmente se encuentran en desarrollo otros antipsicóticos. Es probable que los fármacos de nueva generación tengan un mecanismo de acción diferente (por ejemplo, un perfil GABAérgico) y puedan influir en diversas manifestaciones de la esquizofrenia, incluidos los trastornos por déficit propiamente dichos.
¡Atención!
Para simplificar la percepción de la información, esta instrucción para el uso del medicamento "Neurolépticos o antipsicóticos " se traduce y se presenta en una forma especial sobre la base de las instrucciones oficiales para el uso médico del medicamento. Antes de usar, lea la anotación que vino directamente al medicamento.
Descripción proporcionada con fines informativos y no es una guía para la autocuración. La necesidad de este medicamento, el propósito del régimen de tratamiento, los métodos y la dosis del medicamento están determinados únicamente por el médico tratante. La automedicación es peligrosa para su salud.

