Médico experto del artículo.
Nuevos artículos
Cateterismo cardíaco
Último revisado: 06.07.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
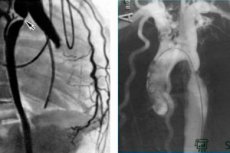
La cateterización de las cavidades cardíacas se realiza mediante punción e inserción percutánea de un catéter en un vaso: una vena periférica (cubital, subclavia, yugular, femoral) para las cámaras derechas del corazón o una arteria (braquial, femoral, axilar, radial) para las cámaras izquierdas del corazón.
Metodología para la realización del cateterismo cardíaco
En caso de estrechamiento grave de la válvula aórtica o su prótesis artificial, cuando es imposible introducir un catéter retrógradamente en el ventrículo izquierdo, se realiza una punción transeptal del tabique interauricular desde la aurícula derecha hacia la izquierda y luego hacia el ventrículo izquierdo. El abordaje vascular más frecuente es el método de Seldinger (1953). Tras anestesia local de la piel y el tejido subcutáneo con una solución de novocaína al 0,5-1 % o una solución de lidocaína al 2 %, y una pequeña incisión en la piel, se punciona una vena o arteria con una aguja. Cuando aparece sangre por la punta proximal de la aguja (pabellón) (es necesario intentar puncionar solo la pared anterior del vaso), se inserta una guía a través de la aguja, se retira esta y se introduce un catéter en el vaso a lo largo de la guía, que, naturalmente, debe ser más largo que el catéter. El catéter se avanza hasta la ubicación deseada bajo control radiológico. En caso de utilizar catéteres flotantes tipo Swan-Gans con balón en el extremo, la ubicación de la punta del catéter se determina mediante la curva de presión. Es preferible instalar un introductor de pared delgada con válvula hemostática y una rama lateral para el lavado vascular, a través de la cual es fácil insertar el catéter y reemplazarlo por otro si es necesario. El catéter y el introductor se lavan con solución isotónica heparinizada de cloruro de sodio para prevenir la formación de trombos. Con diferentes tipos de catéteres, es posible acceder a diferentes partes del corazón y los vasos, medir la presión en ellos, tomar muestras de sangre para oximetría y otras pruebas, introducir la vena cava inferior para determinar parámetros anatómicos, constricciones, flujo sanguíneo, etc.
Si no se puede controlar la ubicación del catéter mediante fluoroscopia (rayos X), se utilizan catéteres con un balón flotante inflable en el extremo, que se mueve con el flujo sanguíneo hacia la aurícula derecha, el ventrículo derecho y la arteria pulmonar, registrando la presión en ellos. La presión de enclavamiento de la arteria pulmonar permite evaluar indirectamente el estado de la función del ventrículo izquierdo y su presión telediastólica (PTD), ya que la PTD del ventrículo izquierdo es la presión promedio en la aurícula izquierda o la presión en los capilares pulmonares. Esto es importante para la monitorización del tratamiento en casos de hipotensión e insuficiencia cardíaca, por ejemplo, en el infarto agudo de miocardio. Si el catéter cuenta con dispositivos adicionales, es posible medir el gasto cardíaco mediante dilución de colorante o termodilución, registrar un electrograma intracavitario y realizar estimulación endocárdica. Las curvas de presión intracavitaria se registran mediante un sensor de presión líquida Statham y un ECG en una grabadora de chorro o computadora, con posibilidad de impresión en papel; sus cambios pueden utilizarse para evaluar una patología cardíaca específica.
Medición del gasto cardíaco
Cabe señalar que no existen métodos absolutamente precisos para medir el gasto cardíaco. Durante el cateterismo cardíaco, se utilizan con mayor frecuencia tres métodos para determinar el gasto cardíaco: el método de Fick, el método de termodilución y el método angiográfico.
El método de Fick
Fue propuesto por Adolph Fick en 1870. El método se basa en la suposición de que, en reposo, el aporte de oxígeno a los pulmones es igual a la cantidad de oxígeno utilizado por los tejidos, y la cantidad de sangre expulsada por el VI es igual al volumen sanguíneo que circula por los pulmones. Se debe extraer sangre venosa mixta, ya que la concentración de oxígeno en la sangre de la vena cava y del seno coronario difiere significativamente. La sangre se extrae del ventrículo derecho o de la arteria pulmonar, que es la preferible. La diferencia de oxígeno arteriovenoso se puede determinar a partir de la concentración de oxígeno en la sangre arterial (Ca) y venosa (Cv). Al calcular el contenido de oxígeno absorbido durante 1 min, se puede calcular el volumen sanguíneo que circula por los pulmones durante el mismo período, es decir, el gasto cardíaco (GC).
MO = Q / Ca - St (l/min),
Donde Q es la absorción de oxígeno por el cuerpo (ml/min).
Conociendo el índice cardíaco, se puede calcular el índice cardíaco (IC). Para ello, se divide el índice cardíaco entre el área de superficie gesellschaft (SGE) del paciente, que se calcula en función de su altura y peso corporal. El índice cardíaco en un adulto es normalmente de 5 a 6 l/min, y el IC es de 2,8 a 3,5 l/min/ m².
Método de termodilución
Este método utiliza una solución isotónica de cloruro de sodio refrigerada (5-10 ml), que se introduce a través de un catéter multilumen en la aurícula derecha. La punta del catéter, con el termistor, se encuentra en la arteria pulmonar. La calibración de las curvas se realiza activando brevemente una resistencia constante, lo que genera desviaciones del dispositivo de registro correspondientes a un cambio de temperatura determinado para un termistor dado. La mayoría de los dispositivos de termodilución están equipados con dispositivos de computación analógicos. Los equipos modernos permiten hasta tres mediciones de MO en sangre en un minuto y múltiples repeticiones de los estudios. El gasto cardíaco, o MO, se determina mediante la siguiente fórmula: MO = V (T1 - T2) x 60 x 1,08 / S (l/min).
Donde V es el volumen del indicador introducido; T1 es la temperatura de la sangre; T2 es la temperatura del indicador; S es el área bajo la curva de dilución; 1,08 es el coeficiente en función de la densidad específica y la capacidad calorífica de la sangre y de la solución isotónica de cloruro de sodio.
Las ventajas de la termodilución, así como la necesidad de cateterizar únicamente el lecho venoso, hacen que este método sea actualmente el más aceptable para determinar el gasto cardíaco en la práctica clínica.
Algunos aspectos técnicos del laboratorio de cateterismo
El personal del laboratorio de angiografía por cateterismo incluye al jefe, médicos, enfermeras de quirófano y técnicos de rayos X (técnicos de rayos X) si se utiliza cine y radiografía de gran formato. En laboratorios que utilizan únicamente películas de video y grabación de imágenes por computadora, no se requieren técnicos de rayos X. Todo el personal del laboratorio debe ser competente en técnicas de reanimación cardiopulmonar, para lo cual el quirófano de rayos X debe contar con la medicación adecuada, un desfibrilador, un dispositivo de estimulación eléctrica cardíaca con un conjunto de catéteres con electrodos, un sistema central de suministro de oxígeno y (preferiblemente) un equipo de ventilación artificial.
Los procedimientos diagnósticos complejos y riesgosos, así como la ICP (angioplastia, implantación de stents, aterectomía, etc.), deberían realizarse preferentemente en clínicas con un equipo de cirugía cardíaca. Según las recomendaciones del Colegio Americano de Cardiología/Asociación Americana del Corazón, la angioplastia y el examen de pacientes con alto riesgo de complicaciones (IAM) pueden ser realizados por especialistas experimentados y cualificados sin necesidad de apoyo de cirugía cardíaca en el hospital si el paciente no puede ser trasladado a un lugar más adecuado sin riesgo adicional. En Europa y otros países (incluida Rusia), las intervenciones endovasculares se realizan cada vez más sin la presencia de cirujanos cardíacos, ya que la necesidad de cirugía cardíaca de emergencia es actualmente extremadamente baja. Un acuerdo con una clínica de cirugía cardiovascular cercana es suficiente para el traslado de emergencia del paciente en caso de complicaciones peri y posoperatorias.
Para mantener la aptitud, cualificación y habilidad de los operadores, el laboratorio debe realizar al menos 300 procedimientos al año, y cada médico debe realizar al menos 150 procedimientos diagnósticos al año. Para cateterismo y angiografía, se requiere una unidad de angiografía por rayos X de alta resolución, un sistema para monitorizar el ECG y la presión intravascular, archivar y procesar imágenes angiográficas, instrumental estéril y diversos tipos de catéteres (los diferentes tipos de catéteres para angiografía coronaria se describen a continuación). La unidad de angiografía debe estar equipada con un accesorio para la adquisición y el archivo de imágenes cineangiográficas o digitales por computadora, y tener la capacidad de obtener imágenes en línea, es decir, con análisis cuantitativo inmediato de las angiografías por computadora.
Cambios en las curvas de presión intracavitaria
Las curvas de presión intracavitaria pueden variar en diversas patologías. Estos cambios son útiles para el diagnóstico al examinar a pacientes con diversas patologías cardíacas.
Para comprender las causas de los cambios de presión en las cavidades cardíacas, es necesario comprender las relaciones temporales entre los procesos mecánicos y eléctricos que ocurren durante el ciclo cardíaco. La amplitud de la onda a en la aurícula derecha es mayor que la de la onda y. Un exceso de la onda y sobre la onda a en la curva de presión de la aurícula derecha indica una alteración del llenado auricular durante la sístole ventricular, lo cual ocurre con la insuficiencia o un defecto de la válvula tricúspide.
En la estenosis tricúspide, la curva de presión auricular derecha se asemeja a la de la aurícula izquierda en la estenosis mitral o la pericarditis constrictiva, con un descenso y una meseta en la diástole media y tardía, típico de las presiones elevadas durante la sístole temprana. La presión auricular izquierda media se corresponde con bastante precisión con la presión de enclavamiento de la arteria pulmonar y la presión diastólica del tronco pulmonar. En la insuficiencia mitral sin estenosis, hay un descenso rápido de la presión al inicio de la sístole (una disminución de la onda y), seguida de un aumento gradual en la diástole tardía (diástasis). Esto refleja el logro del equilibrio entre las presiones auricular y ventricular durante la fase tardía del llenado ventricular. Por el contrario, en pacientes con estenosis mitral, la onda y disminuye lentamente, mientras que la presión en la aurícula izquierda continúa disminuyendo a lo largo de la diástole, y no hay signos de diástasis de la presión del pulso en la aurícula izquierda, ya que se conserva el gradiente de presión auriculoventricular. Si la estenosis mitral se acompaña de un ritmo sinusal normal, la onda α en la aurícula izquierda se conserva y la contracción auricular genera un gradiente de presión elevado. En pacientes con insuficiencia mitral aislada, la onda v se expresa claramente y presenta una curva descendente pronunciada de la línea y.
En la curva de presión ventricular izquierda, el punto de presión de la aurícula izquierda (EDP) precede inmediatamente al inicio de su contracción isométrica y se ubica inmediatamente después de la onda a, antes de la onda c de la presión auricular izquierda. La EDP ventricular izquierda puede aumentar en los siguientes casos: insuficiencia cardíaca, si el ventrículo experimenta una gran carga causada por un flujo sanguíneo excesivo, por ejemplo, en insuficiencia aórtica o mitral; hipertrofia ventricular izquierda, acompañada de una disminución de su distensibilidad, elasticidad y compliancia; miocardiopatía restrictiva; pericarditis constrictiva; y taponamiento cardíaco causado por derrame pericárdico.
En la estenosis valvular aórtica, que se acompaña de obstrucción del flujo sanguíneo desde el ventrículo izquierdo y un aumento de la presión en este en comparación con la presión sistólica en la aorta, es decir, la aparición de un gradiente de presión, la curva de presión ventricular izquierda se asemeja a la curva de presión durante la contracción isométrica. Sus contornos son más simétricos y la presión máxima se desarrolla más tarde que en individuos sanos. Una imagen similar se observa al registrar la presión en el ventrículo derecho en pacientes con estenosis de la arteria pulmonar. Las curvas de presión arterial también pueden diferir en pacientes con diferentes tipos de estenosis aórtica. Así, en la estenosis valvular, se observa un aumento lento y retardado en la onda de pulso arterial, y en la miocardiopatía hipertrófica, el aumento brusco inicial de la presión es reemplazado por una disminución rápida y luego una onda positiva secundaria que refleja obstrucción durante la sístole.
Índices derivados de la presión intraventricular
La tasa de cambio/aumento de la curva de presión intraventricular durante la fase de contracción isovolumétrica se denomina primera derivada (dp/dt). Anteriormente, se utilizaba para evaluar la contractilidad del miocardio ventricular. El valor de dp/dt y la segunda derivada (dp/dt/p) se calculan a partir de la curva de presión intraventricular mediante tecnología electrónica e informática. Los valores máximos de estos indicadores representan los índices de la frecuencia de contracción ventricular y ayudan a evaluar la contractilidad y el estado inotrópico del corazón. Desafortunadamente, la amplia gama de estos indicadores en diferentes categorías de pacientes no permite desarrollar estándares promedio, pero son bastante aplicables en un paciente con datos iniciales y en el contexto del uso de fármacos que mejoran la función contráctil del músculo cardíaco.
Actualmente, al disponer en nuestro arsenal de métodos de examen de pacientes como la ecocardiografía en sus diversas modificaciones, la computarizada (TC), la de haz de electrones y la resonancia magnética (RM), estos indicadores para diagnosticar patologías cardiacas no son tan importantes como antes.
Complicaciones del cateterismo cardíaco
El cateterismo cardíaco es relativamente seguro; sin embargo, como cualquier técnica invasiva, presenta un cierto porcentaje de complicaciones asociadas tanto a la intervención en sí como al estado general del paciente. El uso de catéteres atraumáticos más avanzados y delgados, RVS de baja osmolaridad y/o no iónicos, y unidades angiográficas modernas con procesamiento de imágenes computarizadas en tiempo real para intervenciones invasivas ha reducido significativamente la incidencia de posibles complicaciones. Por lo tanto, la mortalidad durante el cateterismo cardíaco en grandes laboratorios angiográficos no supera el 0,1 %. S. Pepine et al. reportan una tasa de mortalidad general de hasta el 0,14 %, con un 1,75 % para pacientes menores de 1 año, un 0,25 % para personas mayores de 60 años, un 0,03 % para la enfermedad de la arteria coronaria de un solo vaso, un 0,16 % para la enfermedad de tres vasos y un 0,86 % para la enfermedad de la arteria coronaria izquierda. En caso de insuficiencia cardíaca, la mortalidad también aumenta según la clase NUHA: en FC I-II - 0,02%, III y IV FC - 0,12 y 0,67%, respectivamente. En algunos pacientes, el riesgo de complicaciones graves aumenta. Se trata de pacientes con angina inestable y progresiva, infarto de miocardio reciente (menos de 7 días), signos de edema pulmonar debido a isquemia miocárdica, con insuficiencia circulatoria de FC III-IV, insuficiencia ventricular derecha grave, valvulopatías (estenosis aórtica grave e insuficiencia aórtica con una presión de pulso superior a 80 mmHg), cardiopatías congénitas con hipertensión pulmonar e insuficiencia ventricular derecha.
En un análisis multivariable de 58.332 pacientes, los predictores de complicaciones graves fueron insuficiencia cardíaca congestiva grave, hipertensión, cardiopatía coronaria, valvulopatía aórtica y mitral, insuficiencia renal, angina inestable e infarto agudo de miocardio en las primeras 24 horas, y miocardiopatía. En pacientes de 80 años, la mortalidad durante procedimientos diagnósticos invasivos también aumentó al 0,8%, y la incidencia de complicaciones vasculares en el sitio de punción alcanzó el 5%.


 [
[