Médico experto del artículo.
Nuevos artículos
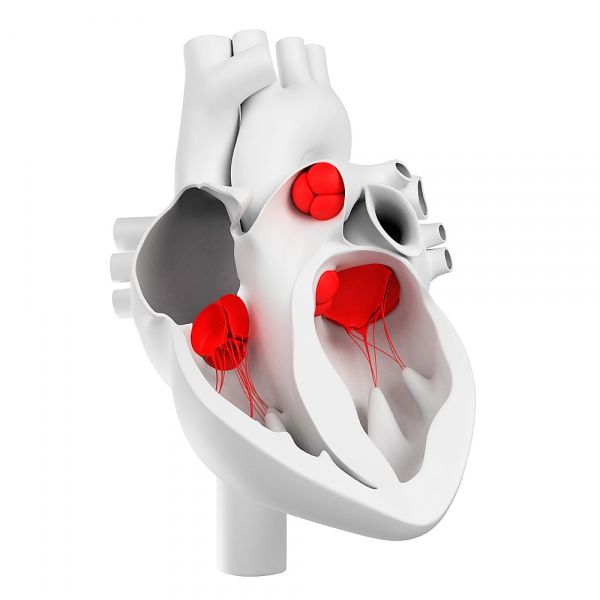
Válvulas cardíacas
Último revisado: 23.04.2024

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
Anteriormente se pensó que todas las válvulas cardíacas son estructuras simples cuya contribución al flujo sanguíneo unidireccional es simplemente un movimiento pasivo en respuesta al gradiente de presión actuante. Esta comprensión de las "estructuras pasivas" condujo a la creación de sustitutos de válvulas mecánicas y biológicas "pasivas".
Ahora se hace evidente que las válvulas cardíacas tienen una estructura y función más complejas. Por lo tanto, la creación de un sustituto de válvula cardíaca "activa" sugiere una similitud significativa en su estructura y función con una válvula cardíaca natural, que a largo plazo es bastante factible debido al desarrollo de la ingeniería tisular.
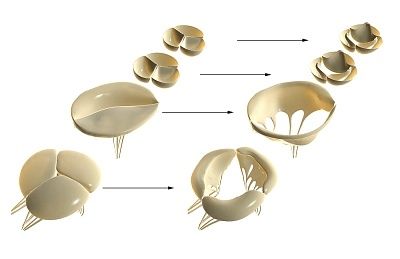
Las válvulas cardíacas se desarrollan a partir de los brotes embrionarios del tejido mesenquimal durante la inserción del endocardio. En el proceso de morfogénesis, se forman el canal auriculoventricular (válvulas cardiacas tricúspide y mitral) y el tracto de salida ventricular (válvulas cardíacas aórtica y pulmonar).
¿Cómo se arreglan las válvulas cardíacas?
El comienzo del estudio del suministro de sangre a las válvulas fue realizado por Luschka (1852), utilizando una inyección de vasos cardíacos con masa contrastante. Encontró numerosos vasos sanguíneos en las válvulas de las válvulas auriculoventriculares y semilunares de la aorta y la arteria pulmonar. Sin embargo, en una serie de guías de anatomía patológica y la histología había indicios de que las válvulas del corazón humanos inalterados no contienen ningún vaso sanguíneo y el segundo que aparece sólo en válvulas en diversos procesos patológicos - arteriosclerosis de diversos etiología y endocarditis. La información sobre la ausencia de vasos sanguíneos se basó principalmente en estudios histológicos. Se supuso que, en ausencia de vasos sanguíneos en la parte libre de las válvulas, su nutrición se produce al filtrar el fluido del plasma sanguíneo que barre las válvulas. Se observó la penetración de unos pocos vasos junto con fibras del tejido muscular estriado en la base de las válvulas y los tendones.
Sin embargo, cuando los vasos de inyección del corazón diferentes colorantes (canal en gelatina, gelatina de bismuto suspensión acuosa rimel negro, las soluciones de carmín o azul de tripano), se encontró que los vasos penetran en las válvulas de cerdechnye atrio-ventricular, arteria aórtica y pulmonar, junto con el tejido muscular cardíaco , ligeramente sin alcanzar el borde libre de la hoja.
En el tejido conectivo fibroso friable de las válvulas de las válvulas atrioventriculares, se encontraron vasos principales separados, anastomosando con los vasos una serie de áreas localizadas de tejido muscular cardíaco transversal.
El mayor número de vasos sanguíneos se localizó en la base y comparativamente menos en la parte libre de estas válvulas.
Según KI Kulchitsky y otros (1990), se encuentra un diámetro mayor de los vasos arteriales y venosos en la válvula mitral. En la base de las válvulas de esta válvula, existen principalmente vasos principales con una red de capilares de angostas redes que penetran en la parte basal de la válvula y ocupan el 10% de su área. En la válvula tricúspide, los vasos arteriales tienen un diámetro más pequeño que en la válvula mitral. En las válvulas de esta válvula hay principalmente vasos tipo dispersos y bucles relativamente anchos de capilares sanguíneos. En la válvula mitral, la hoja frontal está fluyendo sangre más intensamente, en la válvula tricúspide, las válvulas anterior y posterior, que llevan a cabo la función de cierre principal. La relación de los diámetros de los vasos arteriales y venosos en las válvulas auriculoventriculares del corazón de las personas maduras es de 1: 1,5. Los bucles capilares son poligonales y se ubican perpendiculares a la base de las aletas de la válvula. Los vasos forman una red plana localizada debajo del endotelio desde el lado de las aurículas. Los vasos sanguíneos también se encuentran en los cordones de los tendones, donde penetran desde los músculos papilares de los ventrículos derecho e izquierdo a una distancia de hasta el 30% de la longitud de los tendones. Numerosos vasos sanguíneos forman lazos arqueados en la base de los tendones. Las válvulas cardíacas de la aorta y el tronco pulmonar para el suministro de sangre son significativamente diferentes de las auriculoventriculares. Los vasos principales de diámetro relativamente más pequeño se ajustan a la base de las válvulas semilunares de las válvulas aórtica y pulmonar. Las ramas cortas de estos vasos terminan en los bucles capilares de forma irregular ovalada y poligonal. Están ubicados, principalmente, cerca de la base de las alas semilunares. Los vasos venosos en la base de las válvulas de la aorta y la arteria pulmonar también tienen un diámetro menor que en la base de las válvulas auriculoventriculares. La relación de los diámetros de los vasos arteriales y venosos en las válvulas de la aorta y la arteria pulmonar del corazón de las personas maduras es de 1: 1,4. De los vasos más grandes, ramificaciones laterales cortas se ramifican, terminando con capilares de la forma ovalada y poligonal incorrecta.

Con la edad hay un engrosamiento de las fibras del tejido conectivo tales como colágeno y elastina, así como reducir el número de tejido conectivo irregular fibroso suelto desarrolla esclerosis colgajos de tejido válvulas auriculoventriculares y las valvas de válvulas semilunares de la aorta y la arteria pulmonar. Fibras de longitud reducida válvulas de tejido muscular estriado cardíaco y por lo tanto reduce su cantidad y el número de penetrar en las válvulas del corazón vasos sanguíneos. En relación con estos cambios, las válvulas del corazón pierden sus propiedades elásticas y elásticas, lo que afecta el mecanismo de cierre de las válvulas y la hemodinámica.
Las válvulas cardíacas tienen redes capilares linfáticas y un pequeño número de vasos linfáticos equipados con válvulas. Los capilares linfáticos de las válvulas tienen un aspecto característico: su luz es muy irregular, el mismo capilar en diferentes áreas tiene un diámetro diferente. En la unión de varios capilares, se forman extensiones: lagunas de diversas formas. Los bucles de red a menudo son de forma irregular poligonal, con menos frecuencia ovalada o redonda. A menudo, los bucles de la red linfática no están cerrados, y los capilares linfáticos terminan ciegamente. Los bucles capilares linfáticos se orientan más a menudo en la dirección desde el borde libre de la válvula hasta su base. En una serie de casos, se encontró una red de dos capas de capilares linfáticos en las válvulas de la válvula auriculoventricular.
Los plexos nerviosos del endocardio se encuentran en sus diversas capas, principalmente debajo del endotelio. En el borde libre de los colgajos de las válvulas, las fibras nerviosas se localizan, principalmente de forma radial, conectándose con las de los tendones. Más cerca de la base de las válvulas se encuentra un plexo del plexo grande que se conecta al plexo alrededor de los anillos fibrosos. En las válvulas semilunulares, la red neuronal endocardial es más rara. En el lugar de fijación de las válvulas, se vuelve grueso y multicapa.
Estructura celular de las válvulas cardíacas
Las células intersticiales de válvula responsables del mantenimiento de la estructura de la válvula tienen una forma alargada con una gran cantidad de procesos delgados que se extienden a través de toda la matriz de la válvula. Hay dos poblaciones de células intersticiales de válvula, que difieren en morfología y estructura; algunos tienen propiedades contráctiles y se caracterizan por la presencia de fibrillas contráctiles, otros tienen propiedades secretoras y tienen un retículo endoplásmico bien desarrollado y un aparato de Golgi. La función contráctil resiste la presión hemodinámica y es apoyada adicionalmente por la producción de proteínas contráctiles cardíacas y esqueléticas, que incluyen las cadenas pesadas de alfa y beta-miosina y diversas isoformas de troponina. La contracción de la válvula de la válvula cardíaca se demostró en respuesta a una serie de agentes vasoactivos que sugieren la acción coordinadora del estímulo biológico para el funcionamiento exitoso de la válvula.
Las células intersticiales también son componentes necesarios del sistema reductor de estructuras como las válvulas cardíacas. El movimiento constante de las válvulas y la deformación del tejido conectivo asociado con él, produce un daño al cual las células intersticiales de la válvula reaccionan para mantener la integridad de la válvula. El proceso de recuperación es vital para el funcionamiento normal de la válvula, y la ausencia de estas células en modelos modernos de válvulas artificiales es probablemente un factor que contribuye al daño estructural de las bioprótesis.
Una dirección importante en el estudio de las células intersticiales es el estudio de la interacción entre ellas y la matriz circundante, mediada por la adhesión focal de las moléculas. Las adhesiones focales son interacciones especializadas célula-matriz que unen el citoesqueleto de una célula a proteínas de la matriz a través de integrinas. También actúan como sitios de señalización para la transducción, transmitiendo información mecánica desde la matriz extracelular, que puede provocar respuestas, que incluyen, pero no se limitan a, adhesión celular, migración, crecimiento y diferenciación. Comprender la biología celular de las células intersticiales valvulares es vital para establecer los mecanismos a través de los cuales estas células interactúan entre sí y con el medio ambiente, de modo que esta función pueda reproducirse en válvulas artificiales.
En relación con el desarrollo de un área prometedora de la investigación de la válvula cardíaca ingeniería de tejidos interstitsiapnyh células se llevan a cabo usando una amplia variedad de técnicas. Habiendo validado el citoesqueleto de células con tinción para vimentina, desmina, troponina, alfa-actina y miosina del músculo liso alfa-cadena pesada y ligera beta-miosina de cadena-2 de miosina cardiaca, alfa y beta-tubulina. Células contractilidad confirmados respuesta positiva a epinefrin, la angiotensina II, bradicinina, carbacol, cloruro de potasio, el endotelio I. Relación funcional celular determinado y verificado ranurados interacciones karboksiflyuorestseina microinyección. La secreción de matriz instalado tinción para colágeno prolil-4-hidroxilasa / tipo II, fibronectina, sulfato de condroitina, laminina. Inervación está instalado cerca de terminaciones nerviosas motor de proximidad, que afecta a la actividad del neuropéptido Y tirosina hidroxilasa, la acetilcolina, polipéptido intestinal vasoactivo, la sustancia P, kaptsitonin péptido relacionado con el gen. Factores mitogénicos evaluados heredan el factor de crecimiento de plaquetas, factor de crecimiento de fibroblastos básico, la serotonina (5-HT). Los fibroblastos estudiados células intersticiales se caracterizan por una membrana basal incompleta, de largo, procesos citoplasmáticos finos estrecha relación a la matriz, un retículo endoplasmático rugoso bien desarrollado y el aparato de Golgi, la riqueza de los microfilamentos, la formación de una unión adhesiva.
Las células endocardíacas valvulares forman una envoltura atrombogénica funcional alrededor de cada válvula cardíaca, similar al endotelio vascular. El método ampliamente utilizado de reemplazo valvular elimina la función protectora del endocardio, que puede conducir a la deposición de plaquetas y fibrina en las válvulas artificiales, el desarrollo de infección bacteriana y la calcificación tisular. Otra función probable de estas células es la regulación de las células intersticiales valvulares subyacentes, similar a la regulación de las células del músculo liso por el endotelio. Existe una compleja interacción entre el endotelio y las células vecinas, parcialmente mediada por factores solubles secretados por las células endoteliales. Estas células forman una superficie enorme, cubierta de microcrecimientos en el lado luminal, lo que aumenta la exposición y la posible interacción con las sustancias metabólicas de la sangre circulante.
Endotelio menudo muestra diferencias morfológicas y funcionales causados por las tensiones de cizallamiento en la pared del vaso que se produce durante el movimiento de la sangre, y lo mismo se aplica a la válvula de células endocárdicos que reciben tanto alargan y forma poligonal. Los cambios en la estructura de las células pueden ocurrir debido a la acción de los componentes de la hemodinámica del citoesqueleto locales o efecto secundario causado por cambios en la matriz extracelular subyacente. A nivel de la ultraestructura, las células valvulares del endocardio tienen conexiones intercelulares, vesículas plasmáticas, retículo endoplásmico desigual y aparato de Golgi. A pesar del hecho de que producen factor de von Willebrand, tanto in vivo como en un entorno artificial, carecen de la pantorrilla de Weibel-Palade (gránulos específicos que contienen factor von Willebrand), que son orgánulos específicos para el endotelio vascular. Las células endocárdicas valvulares se caracterizan por articulaciones fuertes, interacciones de espacios funcionales y se solapan por pliegues marginales.
Endocardial células retienen su actividad metabólica incluso in vitro: generar factor de Willebrand, la prostaciclina, exhiben actividad de sintasa de óxido nítrico de la enzima convertidora de angiotensina, la adhesión fuertemente aislado moléculas ICAM-1 y ELAM-1, que son críticos para la unión de células mononucleares en el desarrollo de la respuesta inmune. Todos estos marcadores deberían incluirse en el cultivo del cultivo celular ideal para crear una válvula artificial por ingeniería de tejidos, pero el potencial inmunoestimulador de las células endocárdicos válvula mismos pueden limitar su uso.
Válvula cardiaca extracelular Metrix consta de colágeno fibroso y macromoléculas de elastina de proteoglicanos y glicoproteínas. El colágeno es - 60% del peso seco de la válvula, elastina - 10% y proteoglicanos - 20%. El componente de colágeno proporciona la estabilidad mecánica básica de la válvula y está representado por colágeno I (74%). II (24%) y V (2%) tipos. Los manojos de filamentos de colágeno están rodeados por una vaina de elastina que interactúa entre ellos. Cadenas laterales de glicosaminoglicanos de las moléculas de proteoglicanos tienden a formar una sustancia similar a un gel en el que otras moléculas interactúan para formar un permanente interconexiones de la matriz y otros componentes se depositan. Válvula de corazón humano glicosaminoglicanos compone principalmente de ácido hialurónico, en menor medida - de sulfato de dermatán, condroitina-4-sulfato y condroitin-6-sulfato, con un mínimo de heparán sulfato. Remodelación y tejido de la matriz de actualización están regulados por metaloproteinasas de la matriz (MMPs) y sus inhibidores tisulares (TI). Estas moléculas también están involucrados en una amplia gama de procesos fisiológicos y patológicos Algunas metaloproteinasas, incluyendo colagenasa intersticial (MMP-1, MMP-13) y las gelatinasas (MMP-2, MMP-9) y sus inhibidores tisulares (TI-1, cinco 2, TI-3), se encuentran en todas las válvulas del corazón. La sobreabundancia de la producción de metaloproteinasas es típica para las condiciones patológicas de la válvula cardíaca.
 [6], [7], [8], [9], [10], [11], [12], [13], [14], [15], [16]
[6], [7], [8], [9], [10], [11], [12], [13], [14], [15], [16]
Válvulas cardíacas y su estructura morfológica
Las válvulas cardíacas consisten en tres capas morfológicamente diferentes y funcionalmente significativas de la matriz de la válvula: fibrosa, esponjosa y ventricular.
La capa fibrosa forma un marco a prueba de carga del colgajo de válvula, que consiste en capas de fibras de colágeno. Estas fibras están dispuestas radialmente en forma de pliegues para la posibilidad de estirar las válvulas arteriales tras el cierre. La capa fibrosa se encuentra cerca de la superficie externa de salida de estas válvulas. Las capas fibrosas de las válvulas auriculoventriculares sirven como una continuación de los haces de colágeno de los tendones. Se encuentra entre las capas esponjosa (entrada) y ventricular (salida).
Entre la fibra y el ventrículo hay una capa esponjosa (espongiosa). La capa esponjosa consiste en un tejido conectivo mal organizado en un medio viscoso. Los componentes dominantes de la matriz de esta capa son proteoglicanos con colágeno orientado arbitrariamente y capas delgadas de elastina. Las cadenas laterales de las moléculas de proteoglicanos tienen una fuerte carga negativa, que afecta su alta capacidad de unirse al agua y formar el gel poroso de la matriz. La capa de matriz esponjosa reduce las tensiones mecánicas en las válvulas de las válvulas cardíacas y mantiene su flexibilidad.
La capa ventricular es mucho más delgada que otras y está repleta de fibras elásticas que permiten que los tejidos resistan la deformación constante. La elastina tiene una estructura esponjosa que rodea y conecta las fibras de colágeno, y asegura su mantenimiento en un estado plegado neutral. La capa de entrada de la válvula (ventricular para válvulas arteriales y esponjosa para válvulas auriculoventriculares) contiene una mayor cantidad de elastina que la salida, lo que proporciona un ablandamiento del impacto hidráulico al cerrar las válvulas. Esta relación entre colágeno y elastina permite la expansión de las válvulas al 40% sin deformación permanente. Bajo la influencia de una pequeña carga, las estructuras de colágeno de esta capa se orientan en la dirección de carga y aumenta su resistencia al crecimiento posterior de la carga.
Por lo tanto, la idea de las válvulas cardíacas como una duplicación de endocardio inactiva no solo es simplista, sino también, de hecho, incorrecta. Las válvulas cardíacas son un órgano con una estructura compleja, que incluye fibras musculares estriadas, vasos sanguíneos y linfáticos y elementos nerviosos. Tanto en su estructura como en su funcionamiento, las válvulas forman un todo único con todas las estructuras del corazón. El análisis de la función normal de la válvula debe tener en cuenta su organización celular, así como la interacción de las células entre ellas y la matriz. El conocimiento obtenido de tales estudios es líder en el diseño y desarrollo de reemplazo de válvulas mediante la ingeniería de tejidos.

