Médico experto del artículo.
Nuevos artículos
Anemia hipofisaria (enanismo)
Último revisado: 12.07.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
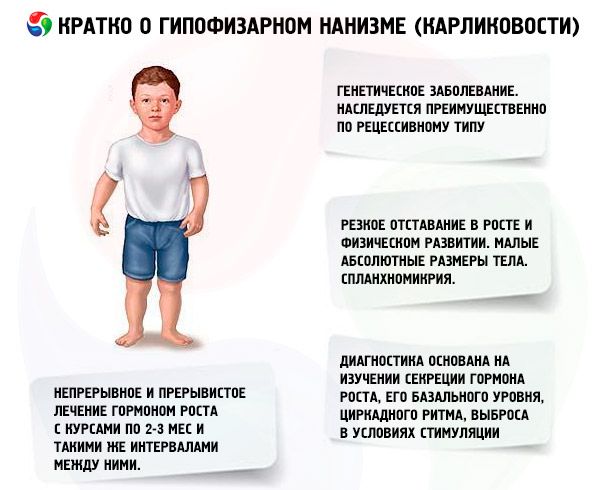
El término "enanismo hipofisario" (del griego nanos - enano; sin.: enanismo, nanosomía, microsomía) en sentido absoluto significa una enfermedad, cuya principal manifestación es un retraso agudo en el crecimiento, asociado con una violación de la secreción de la hormona del crecimiento por la glándula pituitaria anterior.
En un sentido más amplio, el enanismo es un trastorno del crecimiento y del desarrollo físico, cuya aparición puede ser causada no sólo por una deficiencia absoluta o relativa de la hormona somatotrópica debido a una patología de la propia glándula pituitaria, sino también por un trastorno de la regulación hipotalámica (cerebral) de sus funciones, defectos en la biosíntesis de la hormona somatotrópica y trastornos de la sensibilidad de los tejidos a esta hormona.
Causas enanismo
La mayoría de las formas de enanismo hipofisario son enfermedades genéticas. El más común es el enanismo panhipopituitario, que se hereda principalmente de manera recesiva. Se asume que hay dos tipos de transmisión de esta forma de patología: autosómica y a través del cromosoma X. En esta forma de enanismo, junto con el defecto en la secreción de la hormona somatotrópica, la secreción de gonadotropinas y hormona estimulante de la tiroides se altera con mayor frecuencia. La secreción de ACTH se altera con menos frecuencia y en menor grado. Estudios funcionales con hormonas liberadoras, incluyendo la hormona liberadora de somatotropina sintética (que consta de 29, 40 y 44 residuos de aminoácidos), similar al polipéptido pancreático, han demostrado que la mayoría de estos pacientes tienen patología a nivel del hipotálamo, y la insuficiencia de la glándula pituitaria anterior es secundaria. La patología primaria de la glándula pituitaria en sí es menos común.
El enanismo genético con deficiencia aislada de la hormona del crecimiento, con disminución de la actividad biológica y sensibilidad a esta, se observa esporádicamente en Rusia y países vecinos. Es más común en el continente americano, en países de Oriente Próximo y Medio, y en África. Con base en los resultados de un estudio del contenido sanguíneo de hormona somatotrópica y la sensibilidad de los pacientes a la hormona somatotrópica exógena, el nivel de insulina inmunorreactiva (IRI), los factores de crecimiento similares a la insulina (IGF) tipo I (somatomedina C) y tipo II, y la respuesta del IGF-1 al tratamiento con preparados de hormona somatotrópica, se han identificado diversas variantes de enanismo clínicamente similares.
Recientemente se ha descifrado la patogenia del enanismo de Laron, que es causado por una deficiencia de IRF-1 e IRF-II, así como la patogenia del enanismo en pigmeos africanos, asociado a una deficiencia del primero.
En 1984 se describió una nueva variante de enanismo pseudohipofisario con alto nivel de hormona somatotrópica e IGF-1; la génesis del enanismo se explica por un defecto en sus receptores, lo que se demuestra por una fuerte disminución en la unión de los fibroblastos de la piel al IGF-1.
Cabe destacar que en las condiciones modernas, con la presencia de familias pequeñas, muchos casos aislados (“idiopáticos”, esporádicos) de la enfermedad también pueden ser genéticos.
En el análisis de 350 historias clínicas, la etiología del enanismo no fue clara en 228 pacientes (65,2%). Este grupo incluyó pacientes de 57 familias con incidencia repetida de enanismo (2-4 casos por familia), lo que representó el 28% de todos los pacientes. En el 77% de las familias con formas de enanismo etiológicamente poco claras (principalmente genéticas), se estableció una conexión innegable con la herencia de la ausencia del factor Rh. La distribución del factor Rh en familias de pacientes con enanismo difiere de la observada en el conflicto Rh entre la madre y el feto y, por regla general, no se acompaña de enfermedad hemolítica del recién nacido (el padre puede ser Rh negativo y, en caso de heterocigosidad de los padres para el factor Rh, los hijos, etc.). Es posible suponer una conexión entre la actividad de los genes responsables de la síntesis de la hormona somatotrópica (u hormona liberadora de somatotropina) y los genes que determinan el factor Rh, especialmente dado que la mayoría de las formas de enanismo y la ausencia del factor Rh son rasgos autosómicos recesivos. Esto no explica la relativa rareza del enanismo en comparación con la frecuencia de individuos Rh negativos en la población. Probablemente, algunos factores adicionales aún desconocidos sean importantes, pero es improbable que las características de la distribución del factor Rh en familias de pacientes con enanismo familiar y esporádico sean accidentales.
Un gran grupo de pacientes con enanismo (cerebral primario, cerebro-hipofisario) son pacientes con varios tipos de patología orgánica del sistema nervioso central que surgió en el útero o en la primera infancia. El sustrato anatómico que causa esta patología puede ser el subdesarrollo o la ausencia de la glándula pituitaria, su distopía en la patología de la formación de la silla turca, la degeneración quística de la glándula pituitaria, su atrofia debido a la compresión por un tumor (craneofaringioma, adenoma cromófobo, meningioma, glioma). El enanismo puede ser causado por lesiones traumáticas en la región hipotálamo-hipofisaria (intrauterinas, de nacimiento o posnatales), que a menudo ocurren en embarazos múltiples, así como durante el parto en presentación de nalgas, pie o en posición transversal con rotación sobre la pierna (este es el mecanismo del parto en más de 1/3 de los pacientes con enanismo). Los daños infecciosos y tóxicos son importantes (infecciones virales intrauterinas, tuberculosis, sífilis, malaria, toxoplasmosis; enfermedades en edades tempranas, sepsis neonatal, meningoencefalitis y aracnoencefalitis, etc.). Estos procesos pueden dañar la propia glándula pituitaria, los centros hipotalámicos que regulan su función y alterar las conexiones funcionales normales del sistema nervioso central.
Las lesiones fetales intrauterinas pueden dar lugar al nacimiento de pacientes con “enanismo de nacimiento” con secreción normal de hormona de crecimiento (enanismo primordial cerebral, microcefalia, enanismo Silver-Russell con hemiasimetría corporal y niveles elevados de gonadotropinas, etc.).
Factores adicionales que agravan la violación del desarrollo físico en el enanismo pueden ser una nutrición inadecuada, desequilibrada en términos de ingredientes esenciales (deficiencia de proteínas) y microelementos (deficiencia de zinc), y condiciones ambientales desfavorables, así como diversas enfermedades crónicas, como la glomerulonefritis, en la que la azotemia afecta la actividad de los receptores hepáticos o afecta directamente el metabolismo de las células hepáticas, provocando una disminución en la síntesis de somatomedina, o cirrosis del hígado, cuando se altera la formación de somatomedina.
Patogenesia
En la mayoría de los pacientes con enanismo hipofisario, los cambios no se limitan a la patología de la secreción de la hormona somatotrópica y la sensibilidad a ella, sino que se extienden a otras hormonas trópicas de la glándula pituitaria, lo que provoca diversas combinaciones de trastornos endocrinos y metabólicos.
En la deficiencia aislada de hormona somatotrópica, los cambios morfológicos en la hipófisis han sido poco estudiados. En los casos estudiados, rara vez se encontraron trastornos patológicos (craneofaringioma o hiperostosis de los huesos craneales). En este tipo de enanismo, puede observarse un subdesarrollo congénito de células peptidérgicas o un defecto en el sistema de neurotransmisores del hipotálamo. En estos casos, el enanismo puede combinarse con displasia o hipoplasia de los nervios ópticos. Los quistes intraselares y los tumores hipofisarios e hipotalámicos provocan deficiencia de STH, lo que provoca la compresión del tejido hipofisario, en particular de los somatotrofos.
El enanismo se caracteriza por el adelgazamiento de los huesos, principalmente debido a la capa cortical, el retraso en la diferenciación y la osificación del esqueleto. Los órganos internos son hipoplásicos, a veces atróficos, y los músculos están poco desarrollados.
Síntomas enanismo
Un retraso marcado en el crecimiento y el desarrollo físico son las principales manifestaciones del enanismo hipofisario. Los pacientes nacen con un peso y una estatura normales y comienzan a presentar retraso en el crecimiento entre los 2 y los 4 años.
Antes de la llegada del tratamiento activo para el nanismo, se consideraban enanos aquellos con una altura inferior a 120 cm en las mujeres y 130 cm en los hombres. Actualmente, la altura de un enano difiere en al menos 2-3 sigmas de la norma tabular promedio para un sexo, edad o población determinados. También existe un método para la evaluación gráfica de la altura basado en la curva de distribución gaussiana. En este caso, los enanos por altura se incluyen en un grupo que incluye el número mínimo de individuos de la población correspondiente con el mayor desfase con respecto a la norma de crecimiento promedio.
El enanismo hipofisario se caracteriza no solo por un tamaño corporal absoluto pequeño, sino también por un crecimiento anual y un desarrollo físico reducidos. La constitución corporal es proporcional, pero las proporciones corporales de los pacientes son típicas de la infancia. La piel es pálida, a menudo amarillenta y seca, debido a una insuficiencia tiroidea absoluta o relativa; en ocasiones se observa cianosis (piel veteada). En pacientes no tratados, la piel envejecida y arrugada (gerodermia) aparece prematuramente. Esto se debe a la acción anabólica insuficiente de la STH y a la lenta regeneración celular.
El cabello puede ser normal o seco, fino y quebradizo; las pestañas largas son típicas. El crecimiento secundario de cabello suele estar ausente. El tamaño de la silla turca en la mayoría de los pacientes con enanismo (70-75%) no se altera, pero a menudo conserva la forma infantil de un óvalo vertical, presenta un dorso ancho y juvenil, y el seno del hueso esfenoides presenta un retraso en la neumatización. Sin embargo, hay pacientes con una silla turca agrandada, signo de un tumor, con áreas de calcificación en su fondo o en la zona de entrada (con craneofaringioma, efectos residuales de neuroinfección) o con su disminución (signos de subdesarrollo, pequeño tamaño de la glándula pituitaria). Se observan síntomas de hipertensión intracraneal: adelgazamiento de los huesos de la bóveda craneal, aumento del patrón vascular, presencia de huellas dactilares, etc. El signo más importante del enanismo hipofisario es un retraso en la diferenciación y osificación del esqueleto. Las características del sistema dentario también están estrechamente relacionadas con la diferenciación esquelética: se observa un reemplazo tardío de los dientes de leche. El mayor retraso en el desarrollo del sistema esquelético se observa en pacientes con enanismo, disfunción sexual e hipotiroidismo.
Los genitales de la mayoría de los pacientes presentan un desarrollo genital gravemente subdesarrollado, aunque las malformaciones son poco frecuentes. Se observó criptorquidia en el 5,8% de los pacientes varones. La insuficiencia sexual se acompaña de subdesarrollo de los caracteres sexuales secundarios, disminución del deseo sexual y ausencia de menstruación. El desarrollo sexual espontáneo normal solo se observa en pacientes con deficiencia aislada de la hormona del crecimiento y en algunos pacientes con enanismo cerebral.
La insuficiencia tiroidea es un síntoma bastante común de enanismo. Cabe destacar que las manifestaciones externas del hipotiroidismo no siempre reflejan el verdadero estado funcional de la glándula tiroides. Esto se debe a un hipotiroidismo relativo causado por una alteración en la transición de tiroxina (T₄ ) a triyodotironina (T₃ ) y la formación de T₃ inactiva (reversible) , característica de la insuficiencia somatotrópica.
La función adrenocorticotrópica en el enanismo hipofisario disminuye con menor frecuencia y en menor medida que las funciones sexual y estimulante de la tiroides, y en la mayoría de los pacientes no requiere una corrección especial.
En la mayoría de los casos, el intelecto no se ve afectado. Se observan cambios emocionales en forma de infantilismo mental; en pacientes mayores sin deterioro intelectual, a veces se observan neurosis reactivas.
En la patología cerebral orgánica, especialmente de carácter tumoral, el enanismo puede presentarse con síntomas de diabetes insípida, hemianopsia bitemporal y discapacidad intelectual.
El estudio del desarrollo de la actividad bioeléctrica cerebral en pacientes sin síntomas orgánicos del sistema nervioso central mostró que su EEG se caracteriza por rasgos de inmadurez, la conservación a largo plazo de un alto voltaje electroencefalográfico "infantil"; irregularidad del ritmo alfa en amplitud y frecuencia; un marcado aumento de los ritmos θ y δ lentos, especialmente en las derivaciones frontales y centrales; una clara reacción a la hiperventilación; y un desplazamiento del rango de los ritmos del EEG hacia frecuencias bajas, siguiendo los ritmos de la estimulación luminosa (evidencia de una disminución de la movilidad funcional de las estructuras nerviosas cerebrales). Se reveló que en pacientes mayores, la naturaleza inmadura de la actividad eléctrica cerebral se debe al subdesarrollo sexual, y en pacientes de todos los grupos de edad, al hipotiroidismo.
El metabolismo de carbohidratos en pacientes con enanismo se caracteriza por una tendencia a la disminución de la glucemia en ayunas, un aumento durante el esfuerzo físico, insuficiencia de insulina endógena y una mayor sensibilidad a la insulina exógena, con frecuente desarrollo de hipoglucemias. Esto último se explica principalmente por niveles insuficientes de hormonas contrainsulares en el organismo de los pacientes.
Los órganos internos presentan esplacnomicria, es decir, disminución de su tamaño. No se han descrito cambios funcionales en los órganos internos específicos del enanismo. Con frecuencia se observa hipotensión arterial con disminución de la presión sistólica y diastólica, y disminución de la amplitud del pulso. Los ruidos cardíacos están apagados; se auscultan soplos funcionales de diversos orígenes debido a cambios tróficos en el miocardio y trastornos autonómicos. El ECG se caracteriza por bajo voltaje (especialmente en presencia de hipotiroidismo), bradicardia sinusal o bradiarritmia; el PCG muestra una disminución de la amplitud de los tonos, tonos adicionales y soplos funcionales. Los datos de oxigemometría indican hipoxemia (inicial y durante el esfuerzo físico) y déficit de oxígeno. Los pacientes de edad avanzada a veces desarrollan hipertensión.
Diagnostico enanismo
El diagnóstico y el diagnóstico diferencial del enanismo se basan en la anamnesis y un examen clínico, radiológico, de laboratorio y hormonal exhaustivo. Además del tamaño corporal absoluto, para evaluar el crecimiento de los pacientes, se determina el déficit de crecimiento (la diferencia entre la estatura del paciente y su promedio normal para el sexo y la edad correspondientes); la edad de crecimiento (la conformidad de la estatura del paciente con ciertos estándares); y el indicador de desviación normalizada.
I = M - Mcp / δ, donde M es la estatura del paciente, Mcp es la estatura normal promedio para un género y edad determinados, δ es la desviación al cuadrado de Mcp; I menor de 3 es típico de nanismo, I mayor de 3 es típico de gigantismo. Este indicador puede utilizarse para evaluar la dinámica del desarrollo.
El examen radiográfico de pacientes con enanismo revela signos de hipertensión intracraneal, efectos residuales de neuroinfección, calcificaciones y craneosinostosis. El estudio del tamaño, la forma y la estructura de la silla turca se considera un indicador indirecto que caracteriza el tamaño de la glándula pituitaria. Una de las manifestaciones más importantes del retraso del crecimiento patológico es una violación de la diferenciación esquelética. Para evaluar el grado de madurez esquelética, se determina la edad ósea (radiográfica), que corresponde a la diferenciación del tejido óseo; la deficiencia de osificación es el grado de retraso de la osificación con respecto a la norma (en años), y el coeficiente de osificación es el cociente de dividir la edad ósea por los parámetros cronológicos y otros.
El diagnóstico moderno del enanismo es imposible sin estudiar la secreción de la hormona somatotrópica, su nivel basal, ritmo circadiano y liberación bajo estimulación. La mayoría de los pacientes con enanismo hipofisario se caracterizan por un contenido reducido de hormona somatotrópica en el suero sanguíneo. Cuando se determina por el método radioinmunológico, es (según diferentes autores) de (0.87 ± 0.09) a (1.50 ± 0.64) ng/ml, con una norma promedio de (3.81 ± 0.29) ng/ml. Un estudio de los ritmos diarios (circadianos) de secreción de la hormona somatotrópica mostró que su nivel en personas sanas es máximo durante las primeras 2 horas de sueño y entre las 4 y las 6 am. En el enanismo, el contenido de hormona somatotrópica también se reduce durante estas horas.
Para estudiar las reservas de la función somatotrópica, se utilizan diversos estimulantes, examinando el contenido de hormona somatotrópica antes y después de su administración. Se extrae sangre cada 30 minutos durante 2-3 horas. La liberación de hormona somatotrópica tras la estimulación se considera normal, al menos hasta 7-10 ng/ml, y en ocasiones alcanza 20-40 ng/ml. Si no se observa reacción en una de las muestras, se repiten las pruebas con otros estimulantes. Se considera que existe insuficiencia de hormona somatotrópica si no se libera en 2-3 muestras diferentes.
Las pruebas de estimulación más utilizadas son: con la administración intravenosa de 0,1 U (0,75-1,5 U) de insulina por kg de peso corporal del paciente y tras alcanzarse una hipoglucemia (una disminución del 50 % de la glucemia con respecto al nivel inicial), se determina la hormona somatotropa sérica según el esquema descrito. Si se presenta una hipoglucemia grave, se interrumpe la prueba y se administra glucosa al paciente por vía intravenosa. Este es el método diagnóstico clásico más común.
TRH en dosis de 200-500 mcg por vía intravenosa. Identifica eficazmente las reservas hormonales y no causa complicaciones. En combinación con la prueba de insulina, permite evaluar el nivel de daño en el sistema hipotálamo-hipofisario. Una reacción positiva a la TRH en ausencia de hipoglucemia por insulina indica la integridad de la glándula pituitaria y daño a nivel hipotalámico. Las reacciones negativas a la TRH y la hipoglucemia indican daño en la propia glándula pituitaria.
TRH, LH-RH a dosis de 300 mcg por vía intravenosa es similar a la anterior.
La SGH humana es un análogo sintético de un compuesto biológicamente activo aislado de un tumor pancreático. Actualmente, existen tres tipos de SGH sintética: con 29, 40 y 44 residuos de aminoácidos. Se administra por vía intravenosa en dosis de 1 a 3 μg/kg de peso corporal del paciente. La liberación de STH se observa entre 15 y 20 minutos después de la administración; esta prueba es más eficaz que otras para revelar las reservas de hormona de crecimiento endógena. Una reacción positiva a la SGH indica un nivel hipotalámico de daño a la función somatotrópica y una glándula pituitaria intacta; se administra con aminoácidos (monocloruro de L-arginina, ornitina, triptófano, glicina, leucina) por vía intravenosa en una dosis de 0,25 a 0,5 g por kg de peso corporal del paciente. Es eficaz para estudiar las reservas de SGH. Puede causar reacciones alérgicas.
L-dopa oral en dosis de 250-500 mcg. Eficaz y bien tolerada por los pacientes.
También se utilizan pruebas con glucagón, bromo ergocriptina (parlodel), lisina vasopresina, clonidina y carga ergométrica de bicicleta dosificada.
El estudio del estado de la función somatotrópica es necesario no sólo para el diagnóstico del enanismo, sino también para la elección justificada de un método de terapia, ya que el tratamiento con somatotropina es racional sólo en el caso de insuficiencia de la hormona de crecimiento endógena.
Para diagnosticar el enanismo, es fundamental estudiar el contenido de factores de crecimiento similares a la insulina o somatomedinas (especialmente IGF-1 o somatomedina C), mediadores de la acción de la hormona somatotrópica a nivel tisular. Se sabe que el contenido de somatomedina C en el enanismo está reducido, mientras que en la acromegalia está aumentado. El enanismo descrito por Laron es una enfermedad con producción normal de STH, pero con alteración de la formación de IGF-1 e IGF-II. El tratamiento con somatotropina en estos pacientes es ineficaz.
Los indicadores indirectos de la función somatotrópica de la glándula pituitaria son la actividad de la fosfatasa alcalina y el contenido de fósforo inorgánico en el suero. En condiciones hiposomatotrópicas, estos indicadores están reducidos. En la forma panhipopituitaria del enanismo, la secreción de gonadotropinas, a menudo TSH, está reducida, lo que se acompaña de una disminución correspondiente en las funciones de las glándulas sexuales (deficiencia de andrógenos o estrógenos), la glándula tiroides (una disminución en los niveles de T3 , T4 , yodo unido a proteínas - PBI, acumulación de 131 I por la glándula tiroides), y las glándulas suprarrenales (una disminución en la cantidad de cortisol y 17-OCS en el plasma, excreción de 17-KC y 17-OCS en la orina, linfocitosis).
Todos los tipos de enanismo genético hipotálamo-hipofisario se caracterizan por la recidiva de la enfermedad en niños de una familia con herencia autosómica recesiva (más frecuente) o autosómica dominante, con retraso del crecimiento y del desarrollo físico de 2 a 4 años, con un desfase de al menos 2-3 grados con respecto a las normas de crecimiento promedio para un sexo, edad y población determinados, con baja dinámica de crecimiento anual espontáneo y retraso en la osificación. Con niveles bajos de hormona somatotrópica (en 2-3 pruebas de estimulación por debajo de 7 ng/ml), la terapia con hormona somatotrópica es altamente efectiva (logra un aumento de la estatura de al menos 7 cm por año). Con niveles normales o altos de hormona somatotrópica (con su inactividad biológica), la sensibilidad a la hormona puede mantenerse. No se observan cambios en la inteligencia.
En el enanismo genético con insensibilidad tisular a la hormona somatotrópica, el cuadro clínico es similar al de la deficiencia aislada de la hormona del crecimiento, pero el tratamiento con somatotropina resulta ineficaz. En este grupo, se distinguen las siguientes formas principales según el nivel de IRF: con contenido normal (defecto del receptor IRF) y reducido: enanismo tipo Laron (deficiencia de IRF-1 e IRF-II) y el tipo presente en pigmeos africanos (deficiencia de IRF-1).
El enanismo cerebral se caracteriza por enfermedades aisladas en una familia asociadas con daño intrauterino o postnatal al sistema nervioso central, con presencia de cambios orgánicos evidentes en el sistema nervioso central, a menudo combinados con patología del órgano visual, presencia de diabetes insípida, preservación de funciones gonadotrópicas y cambios en la inteligencia.
Algunos tipos de disgenesia y agenesia gonadal se acompañan de baja estatura marcada, en particular el síndrome de Shereshevsky-Turner y el síndrome de disgenesia testicular "turneroide" (en mosaico). Los estudios citogenéticos (cromatina sexual, cariotipo) ayudan en el diagnóstico diferencial, revelando defectos cromosómicos, así como defectos característicos del desarrollo somático y sexual, niveles normales o elevados de hormona somatotrópica endógena e insensibilidad al tratamiento con somatotropina.
Entre los trastornos endocrinos que se presentan con baja estatura, cabe destacar el hipotiroidismo primario, causado por hipoplasia o aplasia congénita de la glándula tiroides, su distopía, defectos enzimáticos en la biosíntesis de hormonas tiroideas y daño autoinmune temprano a la glándula tiroides. En todas estas afecciones, predominan los signos de hipotiroidismo con un nivel elevado de TSH y una disminución de T4 y T3 en el suero sanguíneo. En el mixedema de génesis autoinmune, se detectan anticuerpos contra tiroglobulina, fracciones microsomales y nucleares del tejido tiroideo en la sangre, y el nivel de hormona somatotrópica es normal o reducido. El efecto clínico puede lograrse compensando únicamente el hipotiroidismo.
La baja estatura se acompaña de un desarrollo sexual prematuro y síndrome adrenogenital debido al cierre temprano de las zonas de crecimiento; enfermedad de Itsenko-Cushing, que ocurre en la infancia debido al efecto inhibidor de los glucocorticoides sobre la secreción de la hormona somatotrópica y su efecto catabólico; síndrome de Mauriac: baja estatura e infantilismo de pacientes con diabetes mellitus insulinodependiente grave.
El enanismo hipofisario debe diferenciarse del retraso somatogénico en el desarrollo físico causado por trastornos metabólicos crónicos (en enfermedades del hígado, riñones, tracto gastrointestinal), hipoxia crónica (en enfermedades de los sistemas cardiovascular y respiratorio, en anemia); con enfermedades sistémicas del sistema musculoesquelético (condrodistrofia, osteogénesis imperfecta, enfermedad de exostosis), etc.
El retraso del crecimiento funcional (constitucional) se observa a veces con el inicio tardío de la pubertad en adolescentes aparentemente sanos; hemos descubierto que se asocia principalmente con una insuficiencia transitoria de la actividad gonadotrópica. La secreción de hormona somatotrópica no suele verse afectada o está ligeramente reducida. La estimulación de las gonadotropinas puede acelerar tanto el desarrollo sexual como el crecimiento.
La baja estatura de carácter familiar debe considerarse como una variante del desarrollo fisiológico.
¿Qué es necesario examinar?
Cómo examinar?
¿Qué pruebas son necesarias?
¿A quién contactar?
Tratamiento enanismo
El tratamiento del enanismo es un proceso largo. Esto obliga al médico a distribuir los medios para influir en el crecimiento a lo largo del tiempo para obtener el máximo efecto clínico, observando dos principios básicos:
- aproximación máxima del desarrollo inducido por el tratamiento a las condiciones fisiológicas;
- preservando las zonas de crecimiento epifisario.
Tras muchos años de experiencia en el tratamiento del enanismo, consideramos adecuado el siguiente esquema de terapia por etapas. El diagnóstico de enanismo en pacientes adultos no suele generar dudas. En niños pequeños, si el cuadro clínico no es claro, se requiere un período de diagnóstico de 6 a 12 meses en observación sin terapia hormonal. Durante este tiempo, se prescribe un tratamiento de fortalecimiento general complejo; una nutrición adecuada con un aumento del contenido de proteína animal, verduras y frutas en la dieta, vitaminas A y D, y suplementos de calcio y fósforo. La ausencia de cambios significativos en el crecimiento y el desarrollo físico en este contexto, y la detección de trastornos endocrinos durante la exploración, son la base para iniciar la terapia hormonal.
El principal tipo de terapia patogénica para el enanismo hipofisario es el uso de la hormona de crecimiento humana, ya que la aparición de la mayoría de los casos de enanismo depende indudablemente de una u otra forma de su deficiencia. Debido a la especificidad de especie de esta hormona, solo la somatotropina humana y de primates es activa para los humanos. Un fármaco aislado de la glándula pituitaria de personas que murieron por enfermedades no infecciosas y no neoplásicas se usa ampliamente en la clínica. La somatotropina humana se obtiene por síntesis bacteriana usando Escherichia coli por ingeniería genética. La somatotropina humana también se sintetiza químicamente, pero es extremadamente cara y prácticamente no se usa en la clínica. Los pacientes con deficiencia comprobada de la hormona de crecimiento endógena, con diferenciación esquelética que no exceda el nivel típico de los 13-14 años, son seleccionados para el tratamiento con somatotropina. No hay restricciones de edad para el tratamiento.
Las dosis mínimas efectivas que pueden utilizarse durante el primer período de tratamiento son de 0,03 a 0,06 mg/kg de peso corporal. Las dosis más efectivas son de 2 a 4 mg, 3 veces por semana. El aumento de la dosis única a 10 mg no se acompañó de un aumento adecuado del efecto sobre el crecimiento, pero provocó una rápida formación de anticuerpos contra la somatotropina.
En nuestro país, el trabajo de estudio de la hormona de crecimiento humana se ha realizado desde 1960. Se han probado dos regímenes de tratamiento: continuo e intermitente con cursos de 2-3 meses y los mismos intervalos entre ellos. El aumento promedio de altura de los pacientes durante el primer año de tratamiento fue de 9,52 ± 0,39 cm, el aumento del peso corporal fue de 4,4 ± 0,14 kg. Con el tratamiento continuo a largo plazo, el aumento promedio de altura fue de 0,82 cm/mes, peso corporal - 0,38 kg/mes; con intermitente - 0,75 cm/mes y 0,4 kg/mes, respectivamente. El tratamiento continuo proporcionó un aumento más rápido de la altura con una fuerte disminución del efecto después de 1-1,5 años, con el tratamiento intermitente, la eficacia se mantuvo durante 3-4 años, lo que nos permite considerar el régimen de tratamiento del curso más apropiado. La determinación del nivel de IGF-I (somatomedina C) puede servir como un indicador fiable de la sensibilidad del paciente al tratamiento con somatotropinas. Un aumento del contenido de IGF-I tras la administración de somatotropina permite predecir un efecto positivo de la terapia. Una ventaja importante del tratamiento con somatotropina es que no se acelera la osificación esquelética en comparación con el tratamiento previo.
El tratamiento más importante para el enanismo es el uso de esteroides anabólicos, que estimulan el crecimiento al mejorar la síntesis de proteínas y aumentar los niveles de hormona somatotrópica endógena. El tratamiento se realiza durante varios años, con un reemplazo gradual de algunos fármacos por otros, desde compuestos menos activos a compuestos más activos. Está indicado un cambio de fármacos anabólicos cuando el efecto sobre el crecimiento disminuye después de 2-3 años, lo que conduce a un aumento adicional del crecimiento. El tratamiento se realiza en ciclos (el período de descanso debe ser la mitad del período de tratamiento). En caso de adicción, también se indican descansos más largos (hasta 4-6 meses). Solo se prescribe un esteroide anabólico a la vez. La combinación de 2 o más fármacos es inapropiada, ya que esto no mejora sus efectos metabólicos ni sobre el crecimiento. Esto último depende principalmente de la edad de los pacientes y del grado de diferenciación de los huesos esqueléticos al inicio del tratamiento. El mejor efecto se observa en pacientes menores de 16 a 18 años con osificación esquelética que no exceda el nivel característico de un joven de 14 años. Es aconsejable comenzar el tratamiento inmediatamente después del diagnóstico, generalmente a partir de los 5-7 años. Antes del tratamiento, es necesario evitar la prescripción de gonadotropinas y hormonas sexuales, que, si bien estimulan el crecimiento, aceleran simultáneamente la diferenciación esquelética. El principio de dosificación de esteroides anabólicos es desde las dosis mínimas efectivas hasta las que se incrementan gradualmente. Las dosis recomendadas de los medicamentos más comunes: nerobol (metandrostenol, dianabol) - 0,1-0,15 mg por 1 kg de peso corporal por día por vía oral; nerobolil (durabolin) - 1 mg por 1 kg de peso corporal por mes por vía intramuscular, la dosis mensual se administra en 2-3 dosis, respectivamente, después de 15 o 10 días; Retabolil (deca-durabolin): 1 mg por kg de peso corporal una vez al mes por vía intramuscular. Exceder las dosis indicadas puede provocar androgenización. En dosis fisiológicas, estos compuestos no afectan significativamente el estado de los genitales ni la diferenciación ósea, lo que permite su uso prolongado en pacientes de ambos sexos. Las niñas deben estar bajo supervisión ginecológica, ya que en caso de sobredosis o hipersensibilidad, algunas pacientes pueden desarrollar signos de virilización, que remiten rápidamente al suspender el tratamiento. Los fármacos orales metilados a etilados en la posición 17 pueden causar colestasia; por lo tanto, en enfermedades hepáticas, se debe dar preferencia a los compuestos anabólicos parenterales o combinar los fármacos orales con coleréticos. En muy raras ocasiones, el tratamiento con esteroides anabólicos puede causar reacciones alérgicas (picor, erupciones cutáneas). En ausencia de complicaciones, se utilizan esteroides anabólicos mientras se observe el efecto de crecimiento (hasta los 16-18 años, y en ocasiones durante más tiempo). El tratamiento se realiza en el contexto de una terapia de fortalecimiento general.
Si los pacientes presentan signos de hipotiroidismo, se prescriben simultáneamente medicamentos para la tiroides (tiroxina, tiroidina, tirotomía) en dosis seleccionadas individualmente.
En el tratamiento de varones, el siguiente paso es la administración de gonadotropina coriónica humana. Este fármaco se utiliza no antes de los 15-16 años, e incluso a una edad más avanzada, para estimular las células de Leydig, lo que acelera el desarrollo sexual y el crecimiento (gracias a la actividad anabólica de sus propios andrógenos). Se administran dosis de 1000 a 1500 UI, 1 o 2 veces por semana por vía intramuscular, en ciclos de 2 meses, con un máximo de 2 o 3 veces al año. Si el efecto es incompleto, el tratamiento con gonadotropina coriónica humana en varones mayores de 16 años se alterna con la administración de pequeñas dosis de andrógenos (metiltestosterona a una dosis de 5-10 mg/día por vía sublingual).
Las niñas mayores de 16 años pueden comenzar el tratamiento con pequeñas dosis de estrógenos, simulando un ciclo sexual normal. El tratamiento se realiza durante 3 semanas de cada mes, seguidas de un descanso. En la segunda fase del ciclo, a partir de la tercera semana, se puede prescribir gonadotropina coriónica en dosis de 1000-1500 UI, de 3 a 5 veces por semana, o fármacos con efecto gestágeno (pregnin, progesterona).
La etapa final del tratamiento (tras el cierre de las zonas de crecimiento) consiste en la administración constante de dosis terapéuticas de hormonas sexuales según el sexo del paciente, con el fin de desarrollar plenamente los genitales y las características sexuales secundarias, así como asegurar la libido y la potencia sexual. Las preparaciones combinadas de estrógeno y progestágeno (non-ovlon, bisecurin, infekundin, rigevidon) son convenientes para el tratamiento de mujeres, y las preparaciones de andrógenos de liberación prolongada (testenate, sustanon-250, omnadren-250) son convenientes para el tratamiento de hombres.
Se realiza un tratamiento general de fortalecimiento (régimen, dieta proteico-vegetal, terapia vitamínica, bioestimulantes). Se indica el uso de preparados de zinc, cuyo mecanismo de acción principal reside en el aumento de la actividad del IGF-1 (factor de crecimiento insulínico tipo I).
En presencia de patología orgánica del sistema nervioso central, se administra terapia antiinflamatoria, reabsortiva y de deshidratación. La terapia sistemática dirigida produce un efecto alentador. Como resultado del tratamiento a largo plazo por etapas, 148 (80,4%) de 175 pacientes con enanismo de ambos sexos lograron alcanzar una estatura superior a 130 cm, 92 (52,5%), superior a 140 cm, y 32 (18,3%), de 150 a 160 cm o más. Al mismo tiempo, 37 pacientes (21,2%) aumentaron su estatura en 30 cm, 107 (61,1%), de 31 a 50 cm, y 31 (17,7%), de 51 a 60 cm o más.
Pronóstico
El pronóstico depende del tipo de enanismo. En los tipos genéticos de enanismo, el pronóstico de vida es favorable. En presencia de un tumor hipofisario y daño orgánico al sistema nervioso central, este se determina por la dinámica del desarrollo del proceso patológico principal. Los métodos terapéuticos modernos han mejorado significativamente la capacidad física y laboral de los pacientes, prolongando su esperanza de vida. Durante el tratamiento activo, los pacientes deben ser examinados por un médico cada 2-3 meses, y con terapia de mantenimiento, cada 6-12 meses.
El empleo de los pacientes que corresponda a sus capacidades intelectuales y físicas es de suma importancia para su adaptación social.
Es recomendable elegir profesiones que no impliquen un esfuerzo físico intenso, pero que permitan demostrar capacidades intelectuales, capacidad para realizar trabajos precisos y conocimientos de idiomas.


 [
[