Médico experto del artículo.
Nuevos artículos
Síndrome de ovario poliquístico.
Último revisado: 04.07.2025

Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
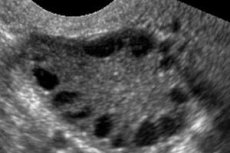
El síndrome de ovario poliquístico es una patología heterogénea y multifactorial que se caracteriza por trastornos del ciclo menstrual, anovulación crónica, hiperandrogenismo, cambios quísticos en los ovarios e infertilidad. Se caracteriza por obesidad moderada, menstruaciones irregulares o amenorrea y síntomas de exceso de andrógenos (hirsutismo, acné). Los ovarios suelen contener numerosos quistes. El diagnóstico se basa en pruebas de embarazo, niveles hormonales y una exploración para descartar un tumor virilizante. El tratamiento es sintomático.
Causas síndrome de ovario poliquístico
El síndrome de ovario poliquístico es una patología endocrina común del aparato reproductor, que se presenta en el 5-10% de las pacientes. Se caracteriza por anovulación y exceso de andrógenos de etiología desconocida. Los ovarios pueden ser de tamaño normal o estar agrandados, con una cápsula lisa y engrosada. Por lo general, los ovarios contienen numerosos quistes foliculares pequeños de 26 mm; en ocasiones, se encuentran quistes grandes con células atrésicas. Los niveles de estrógeno aumentan, lo que conlleva un mayor riesgo de hiperplasia endometrial y, en última instancia, de cáncer de endometrio. Los niveles de andrógenos suelen estar elevados, lo que aumenta el riesgo de síndrome metabólico e hirsutismo.
 [ 13 ]
[ 13 ]
Patogenesia
Las mujeres con síndrome de ovario poliquístico (SOP) presentan anomalías en el metabolismo de andrógenos y estrógenos, así como una síntesis androgénica deficiente. La enfermedad se acompaña de altas concentraciones séricas de hormonas androgénicas como testosterona, androstenediona, sulfato de dehidroepiandrosterona y DHEA-S. Sin embargo, en ocasiones se pueden determinar niveles normales de andrógenos.
El SOP también se asocia con resistencia a la insulina, hiperinsulinemia y obesidad. La hiperinsulinemia también puede provocar la supresión de la síntesis de SHBG, lo que a su vez puede potenciar las características androgénicas.
Además, la resistencia a la insulina en el SOP está asociada con la adiponectina, una hormona secretada por los adipocitos que regula el metabolismo de los lípidos y los niveles de glucosa en sangre.
El aumento de los niveles de andrógenos se acompaña de un aumento del efecto estimulante de la hormona luteinizante (LH), secretada por la hipófisis anterior, lo que induce el crecimiento de las células de la teca ovárica. Estas células, a su vez, aumentan la síntesis de andrógenos (testosterona, androstenediona). Debido a la disminución de los niveles de hormona folículo estimulante (FSH) en relación con la LH, las células granulares ováricas no pueden aromatizar los andrógenos en estrógenos, lo que provoca una disminución de los niveles de estrógenos y la consiguiente anovulación.
Algunas evidencias sugieren que los pacientes tienen un deterioro funcional de la citocromo P450c17, 17-hidroxilasa, que inhibe la biosíntesis de andrógenos.
El síndrome de ovario poliquístico es un síndrome genéticamente heterogéneo. Estudios en familiares con SOP demuestran una herencia autosómica dominante. Recientemente, se ha confirmado un vínculo genético entre el SOP y la obesidad. Una variante del gen FTO (rs9939609, que predispone a la obesidad general) se asocia significativamente con la susceptibilidad al desarrollo del SOP. Se han identificado polimorfismos del locus 2p16 (2p16.3, 2p21 y 9q33.3) asociados con el síndrome de ovario poliquístico, así como el gen que codifica el receptor de la hormona luteinizante (LH) y la gonadotropina coriónica humana (hCG).
Síntomas síndrome de ovario poliquístico
Los síntomas del síndrome de ovario poliquístico comienzan durante la pubertad y disminuyen con el tiempo. La menstruación regular durante un tiempo después de la menarquia descarta el diagnóstico de síndrome de ovario poliquístico. El examen suele revelar abundante moco cervical (que refleja altos niveles de estrógeno). El diagnóstico de síndrome de ovario poliquístico se puede sospechar si una mujer presenta al menos dos síntomas típicos (obesidad moderada, hirsutismo, menstruaciones irregulares o amenorrea).
La combinación más común de síntomas clínicos es:
- trastornos del ciclo menstrual (oligomenorrea, sangrado uterino disfuncional, amenorrea secundaria);
- anovulación;
- esterilidad;
- hirsutismo;
- trastorno del metabolismo de las grasas (obesidad y síndrome metabólico);
- diabetes;
- síndrome de apnea obstructiva del sueño.
¿Qué te molesta?
Diagnostico síndrome de ovario poliquístico
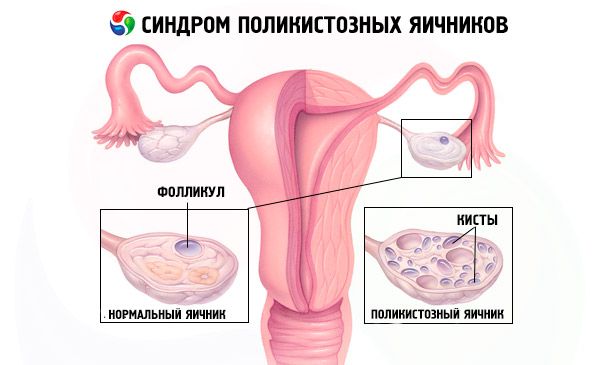
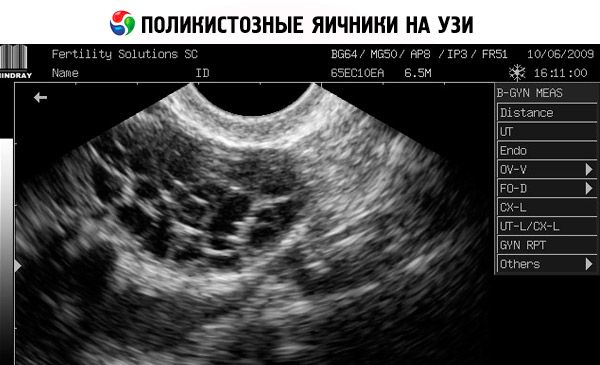
El diagnóstico se basa en descartar un embarazo (prueba de embarazo) y en el análisis de estradiol, FSH, TSH y prolactina en suero. El diagnóstico se confirma mediante ecografía, que revela más de 10 folículos en el ovario; estos folículos suelen encontrarse en la periferia y se asemejan a un collar de perlas. Si se observan folículos en los ovarios e hirsutismo, se deben determinar los niveles de testosterona y DHEAS. Los niveles patológicos se evalúan como en la amenorrea.
 [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ]
[ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ]
Historia y examen físico
Mediante una anamnesis exhaustiva, se identifican los factores hereditarios que contribuyen al desarrollo del síndrome de ovario poliquístico. Durante la exploración, se calculan el índice de masa corporal (IMC) y el índice cintura-cadera (normalmente ≤ 0,8) para diagnosticar el sobrepeso y la obesidad.
El síndrome de ovario poliquístico se caracteriza por el polimorfismo de los signos clínicos y de laboratorio.
Métodos de diagnóstico especiales para el síndrome de ovario poliquístico
Es obligatorio realizar un estudio hormonal entre el tercer y el quinto día de la reacción similar a la menstruación: se determinan los niveles sanguíneos de LH, FSH, prolactina, testosterona, andrógenos suprarrenales (DHEAS) y 17-hidroxiprogesterona. El síndrome de ovario poliquístico se caracteriza por un índice LH/FSH elevado (de 2,5 a 3) (debido a un aumento de los niveles de LH) e hiperandrogenismo.
Para determinar el origen del hiperandrogenismo, se realiza una prueba de ACTH para el diagnóstico diferencial con el hiperandrogenismo causado por una mutación del gen que codifica la enzima 21-hidroxilasa en las glándulas suprarrenales (diagnóstico de las formas latentes del síndrome adrenogenital). Técnica: a las 9:00 h, se extrae sangre de la vena cubital, se administra 1 mg del fármaco Synacthen-Depot por vía intramuscular y, tras 9 horas, se vuelve a extraer sangre. Se determina la concentración de cortisol y 17-hidroxiprogesterona en ambas muestras de sangre y, a continuación, se calcula un coeficiente mediante una fórmula especial, cuyos valores no deben superar 0,069. En estos casos, la prueba es negativa y la mujer (o el hombre) no es portador de la mutación del gen 21-hidroxilasa.
La prueba de difenina se realiza para detectar formas centrales del síndrome de ovario poliquístico y la posibilidad de tratamiento con neurotransmisores. Técnica de la prueba: se determina la concentración inicial de LH y testosterona en sangre; posteriormente, se toma una tableta de difenina 3 veces al día durante 3 días, tras lo cual se vuelve a determinar la concentración de estas mismas hormonas en sangre. La prueba se considera positiva si los niveles de LH y testosterona disminuyen.
- La ecografía de los genitales revela ovarios agrandados (10 cm3 o más), folículos múltiples de hasta 9 mm de diámetro, engrosamiento del estroma ovárico y engrosamiento de la cápsula.
- Además, si se sospecha resistencia a la insulina, se realiza una prueba de tolerancia a la glucosa para determinar los niveles de insulina y glucosa antes y después del ejercicio.
- Si se sospecha génesis suprarrenal del síndrome de ovario poliquístico, se recomienda asesoramiento genético y genotipificación HLA.
- Histerosalpingografía.
- Laparoscopia.
- Evaluación de la fertilidad del esperma del cónyuge.
En noviembre de 2015, la Asociación Americana de Endocrinólogos Clínicos (AACE), el Colegio Americano de Endocrinología (ACE) y la Sociedad de Exceso de Andrógenos y SOP (AES) publicaron nuevas directrices para el diagnóstico del SOP. Estas directrices son:
- Los criterios de diagnóstico del síndrome de ovario poliquístico deben incluir uno de los tres criterios siguientes: anovulación crónica, hiperandrogenismo clínico y enfermedad de ovario poliquístico.
- Además de los hallazgos clínicos, se deben medir los niveles séricos de 17-hidroxiprogesterona y de la hormona antimülleriana para diagnosticar el SOP.
- Los niveles de testosterona libre son más sensibles para detectar el exceso de andrógenos que los niveles de testosterona total.
¿Qué es necesario examinar?
¿A quién contactar?
Tratamiento síndrome de ovario poliquístico
A las mujeres con ciclos menstruales anovulatorios (antecedentes de menstruaciones ausentes o irregulares y sin evidencia de producción de progesterona), sin hirsutismo y sin deseo de quedar embarazadas se les administra una progestina intermitente (por ejemplo, medroxiprogesterona 5 a 10 mg por vía oral una vez al día durante 10 a 14 días cada mes durante 12 meses) o anticonceptivos orales para reducir el riesgo de hiperplasia y cáncer endometrial y para disminuir los niveles circulantes de andrógenos.
En mujeres con síndrome de ovario poliquístico, ciclos anovulatorios e hirsutismo que no planean un embarazo, el tratamiento se centra en reducir el hirsutismo y regular los niveles séricos de testosterona y DHEAS. Las mujeres que desean concebir se someten a un tratamiento de infertilidad.
El tratamiento de la infertilidad en el síndrome de ovario poliquístico se realiza en 2 etapas:
- Etapa 1 – preparatoria;
- Etapa 2 – estimulación de la ovulación.
La terapia en la etapa preparatoria depende de la forma clínica y patogénica del síndrome de ovario poliquístico.
- En casos de síndrome de ovario poliquístico y obesidad, se recomienda prescribir medicamentos que ayuden a reducir la resistencia a la insulina: el fármaco de elección es la metformina, por vía oral a 500 mg 3 veces al día durante 3-6 meses.
- En la forma ovárica del síndrome de ovario poliquístico y niveles elevados de LH, se utilizan fármacos que ayudan a reducir la sensibilidad del sistema hipotálamo-hipofisario hasta completar la supresión de la función ovárica (nivel de estradiol sérico < 70 pmol/l):
- aerosol de buserelina, 150 mcg en cada fosa nasal 3 veces al día a partir del día 21 o 2 del ciclo menstrual, durante 1 a 3 meses, o
- buserelina depot intramuscular 3,75 mg una vez cada 28 días a partir del día 21 o 2 del ciclo menstrual, durante 1 a 3 meses, o
- leuprorelina por vía subcutánea 3,75 mg una vez cada 28 días a partir del día 21 o 2 del ciclo menstrual, durante 1 a 3 meses, o
- triptorelina por vía subcutánea 3,75 mg una vez cada 28 días o 0,1 mg una vez al día a partir del día 21 o 2 del ciclo menstrual, durante 1–3 meses.
En principio, no importa a partir del día 21 o 2 del ciclo menstrual a partir del cual se prescriban los agonistas de la GnRH; sin embargo, es preferible prescribirlos a partir del día 21, ya que en este caso no se forman quistes ováricos. Cuando se prescriben a partir del día 2 del ciclo, la fase de activación que precede a la fase de supresión en el mecanismo de acción del agonista de la GnRH coincide con la fase folicular del ciclo y puede causar la formación de quistes ováricos.
Medicamentos alternativos:
- etinilestradiol/dienogest por vía oral 30 mcg/2 mg una vez al día desde el día 5 hasta el día 25 del ciclo menstrual, durante 3 a 6 meses o
- acetato de etinilestradiol/ciproterona por vía oral 35 mcg/2 mg una vez al día desde el día 5 hasta el día 25 del ciclo menstrual, duración de 3 a 6 meses.
- En la forma suprarrenal del síndrome de ovario poliquístico está indicada la administración de fármacos glucocorticoides:
- dexametasona por vía oral 0,25–1 mg una vez al día, ciclo de 3 a 6 meses, o
- metilprednisolona por vía oral 2–8 mg una vez al día, tratamiento de 3 a 6 meses, o
- prednisolona por vía oral 2,5–10 mg una vez al día, ciclo de 3 a 6 meses.
- Para la forma central del síndrome de ovario poliquístico se utilizan anticonvulsivos:
- difenina 1 comprimido por vía oral 1-2 veces al día;
- carbamazepina por vía oral 100 mg 2 veces al día, ciclo 3-6 meses.
En la 2ª etapa se realiza la estimulación de la ovulación.
La elección de los fármacos y su pauta de administración se determina teniendo en cuenta los datos clínicos y de laboratorio. Durante la inducción de la ovulación, se realiza una ecografía minuciosa y un seguimiento hormonal del ciclo estimulado.
Es inaceptable inducir la ovulación con ningún medicamento sin monitorización ecográfica. No es apropiado iniciar la inducción de la ovulación si se presentan formaciones quísticas en los ovarios con un diámetro > 15 mm y un grosor endometrial > 5 mm.
La inducción de la ovulación con clomifeno está indicada en mujeres jóvenes con historia corta de la enfermedad y niveles suficientes de estrógenos (estradiol sérico < 150 pmol/l) y niveles bajos de LH (> 15 UI/l).
El clomifeno se prescribe por vía oral, 100 mg una vez al día desde el quinto hasta el noveno día del ciclo menstrual a la misma hora del día.
Se realiza una ecografía de control el décimo día del ciclo, donde se evalúa el diámetro del folículo dominante y el grosor del endometrio. Las exploraciones se realizan cada dos días, y durante el período periovulatorio, a diario. Lo importante no es el día del ciclo, sino el tamaño del folículo dominante: si su diámetro es superior a 16 mm, es necesario realizar una ecografía diaria hasta que alcance los 20 mm.
Regímenes de tratamiento alternativos (con efecto antiestrogénico pronunciado):
Esquema 1:
- clomifeno por vía oral 100 mg 1 vez al día desde el día 5 hasta el 9 del ciclo menstrual a la misma hora del día +
- etinilestradiol (EE) por vía oral 50 mcg 2 veces al día desde el día 10 hasta el día 15 del ciclo menstrual o
- estradiol por vía oral 2 mg 2 veces al día del día 10 al 15 del ciclo menstrual.
Esquema 2:
- clomifeno por vía oral 100 mg 1 vez al día desde el 3º al 7º día del ciclo menstrual a la misma hora del día +
- menotropinas por vía intramuscular 75–150 UI una vez al día a la misma hora desde el séptimo al octavo día del ciclo menstrual o
- folitropina alfa por vía intramuscular, 75–150 UI una vez al día a la misma hora a partir del séptimo u octavo día del ciclo menstrual.
La inducción de la ovulación con citrato de clomifeno no está indicada en las siguientes situaciones:
- en hipoestrogenismo (nivel sérico de estradiol < 150 pmol/l);
- después de una preparación preliminar con agonistas de GnRH (como resultado de la disminución de la sensibilidad del sistema hipotálamo-hipofisario-ovárico, se desarrolla hipoestrogenismo);
- En mujeres en edad reproductiva avanzada, con antecedentes de la enfermedad y niveles séricos elevados de LH (> 15 UI/L), no es adecuado aumentar la dosis de clomifeno a 150 mg/día durante ciclos de estimulación repetidos, ya que aumenta el efecto antiestrogénico periférico negativo.
No se recomienda realizar más de 3 ciclos consecutivos de estimulación con clomifeno; si el tratamiento es ineficaz, se deben utilizar gonadotropinas.
La estimulación de la ovulación con gonadotropinas está indicada en ausencia de una foliculogénesis adecuada tras la estimulación con clomifeno, en presencia de un efecto antiestrogénico periférico pronunciado o en presencia de una saturación estrogénica insuficiente. Puede realizarse tanto en pacientes jóvenes como en edad reproductiva avanzada.
Medicamentos de elección:
- menotropinas por vía intramuscular 150–225 UI una vez al día desde el tercer al quinto día del ciclo menstrual al mismo tiempo, durante 7–15 días o
- urofolitropina por vía intramuscular 150–225 UI una vez al día desde el 3º al 5º día del ciclo menstrual a la misma hora, durante 7–15 días.
Medicamentos alternativos (para alto riesgo de desarrollar síndrome de hiperestimulación ovárica):
- Folitropina alfa por vía intramuscular, 100-150 UI una vez al día, del 3.º al 5.º día del ciclo menstrual, a la misma hora, durante 7-15 días. La inducción de la ovulación con gonadotropinas y análogos de la GnRH está indicada en presencia de síndrome de ovario poliquístico con niveles elevados de LH en suero (> 15 UI/L).
Medicamentos de elección:
- buserelina en forma de spray de 150 mcg en cada fosa nasal 3 veces al día a partir del día 21 del ciclo menstrual o
- buserelina depot por vía intramuscular 3,75 mg una vez el día 21 del ciclo menstrual;
- leuprorelina por vía subcutánea 3,75 mg una vez el día 21 del ciclo menstrual;
- triptorelina por vía subcutánea 3,75 mg una vez el día 21 del ciclo menstrual o 0,1 mg una vez al día a partir del día 21 del ciclo menstrual +
- menotropinas por vía intramuscular 225–300 UI una vez al día desde el segundo al tercer día del ciclo menstrual siguiente a la misma hora.
Medicamentos alternativos (para alto riesgo de desarrollar síndrome de hiperestimulación ovárica):
- menotropinas por vía intramuscular 150–225 UI una vez al día desde el segundo al tercer día del ciclo menstrual a la misma hora o
- folitropina alfa por vía intramuscular 150–225 UI una vez al día desde el segundo al tercer día del ciclo menstrual a la misma hora +
- ganirelix por vía subcutánea 0,25 mg una vez al día, a partir del 5º-7º día de uso de gonadotropina (cuando el folículo dominante alcanza un tamaño de 13-14 mm);
- cetrorelix por vía subcutánea 0,25 mg una vez al día, a partir del 5º-7º día de uso de gonadotropina (cuando el folículo dominante alcanza un tamaño de 13-14 mm).
Inducción de la ovulación en pacientes en edad reproductiva tardía (con respuesta ovárica débil a fármacos gonadotrópicos).
Medicamentos de elección:
- menotropinas por vía intramuscular 225 UI una vez al día desde el 3º al 5º día del ciclo menstrual a la misma hora +
- triptorelina por vía subcutánea 0,1 mg una vez al día a partir del segundo día del ciclo menstrual.
Medicamentos alternativos:
- triptorelina por vía subcutánea 0,1 mg una vez al día a partir del segundo día del ciclo menstrual +
- folitropina alfa por vía intramuscular 200–225 UI una vez al día desde el tercer al quinto día del ciclo menstrual a la misma hora.
En todos los esquemas que utilizan gonadotropinas, la dosis adecuada se evalúa según la dinámica del crecimiento folicular (normalmente 2 mm/día). Si el crecimiento folicular es lento, la dosis se incrementa en 75 UI; si el crecimiento es demasiado rápido, se reduce en 75 UI.
En todos los esquemas, si existe un folículo maduro de 18-20 mm y el espesor endometrial es de al menos 8 mm, se suspende la terapia y se administra gonadotropina coriónica humana por vía intramuscular en dosis única de 10.000 UI.
Una vez confirmada la ovulación, se mantiene la fase lútea del ciclo.
Medicamentos de elección:
- didrogesterona por vía oral 10 mg 1-3 veces al día, ciclo de 10 a 12 días o
- Progesterona oral 100 mg 2-3 veces al día, vaginal 100 mg 2-3 veces al día, intramuscular 250 mg 1 vez al día, tratamiento de 10-12 días. Medicamento alternativo (si no hay síntomas de hiperestimulación ovárica):
- gonadotropina coriónica humana por vía intramuscular 1500–2500 UI una vez al día los días 3,5 y 7 de la fase lútea.
Otros medicamentos utilizados en el tratamiento del SOP:
- Antiandrógenos (p. ej., espironolactona, leuprolida, finasterida).
- Medicamentos hipoglucemiantes (p. ej., metformina, insulina).
- Moduladores selectivos del receptor de estrógeno (por ejemplo, citrato de clomifeno).
- Medicamentos para el acné (por ejemplo, peróxido de benzoilo, crema de tretinoína (0,02-0,1 %)/gel (0,01-0,1 %)/solución (0,05 %), crema de adapaleno (0,1 %)/gel (0,1 %, 0,3 %)/solución (0,1 %), eritromicina 2 %, clindamicina 1 %, sulfetamida sódica 10 %).
Efectos secundarios del tratamiento
Al usar clomifeno, la mayoría de las pacientes desarrollan un efecto antiestrogénico periférico, que consiste en un retraso en el crecimiento del endometrio con respecto al crecimiento folicular y una disminución en la cantidad de moco cervical. Al usar gonadotropinas, especialmente gonadotropina menopáusica humana (menotropinas), puede desarrollarse síndrome de hiperestimulación ovárica (SHO); al usar FSH recombinante (folitropina alfa), el riesgo de síndrome de hiperestimulación ovárica es menor. Al usar regímenes que incluyen agonistas de la GnRH (triptorelina, buserelina, leuprorelina), el riesgo de síndrome de hiperestimulación ovárica aumenta, y el uso de agonistas de la GnRH puede causar síntomas de deficiencia de estrógenos: sofocos, sequedad de piel y mucosas.
Pronóstico
La efectividad del tratamiento de la infertilidad en el síndrome de ovario poliquístico depende de las características clínicas y hormonales del curso de la enfermedad, la edad de la mujer, la idoneidad de la terapia preparatoria y la correcta selección del régimen de inducción de la ovulación.
En el 30% de las mujeres jóvenes con una historia corta de la enfermedad, se puede lograr el embarazo después de un tratamiento preparatorio sin inducción de la ovulación.
La eficacia de la estimulación de la ovulación con clomifeno no supera el 30% por mujer; el 40% de las pacientes con síndrome de ovario poliquístico son resistentes al clomifeno.
El uso de menotropinas y urofolitropina permite lograr el embarazo en el 45-50% de las mujeres, pero estos fármacos aumentan el riesgo de desarrollar síndrome de hiperestimulación ovárica.
Los esquemas más efectivos son los que utilizan agonistas de la GnRH, que permiten evitar los picos de LH "parasitarios": hasta el 60% de los embarazos por mujer. Sin embargo, al usar estos fármacos, se observa el mayor riesgo de complicaciones: formas graves del síndrome de hiperestimulación ovárica y embarazo múltiple. El uso de antagonistas de la GnRH no es menos efectivo, pero no se asocia con un alto riesgo de síndrome de hiperestimulación ovárica.
 [ 34 ]
[ 34 ]

